安全対策
ハイゼントラによる治療を受ける患者さんへ(インフォームドコンセント動画)
患者さん、ご家族の方に安心してお使いいただくために、ハイゼントラの安全性や副作用などについて、動画でご説明いたします。
ハイゼントラの製造工程
ハイゼントラの製造工程には、ウイルス混入リスクを考慮し、さまざまな対策が組み込まれています。
試験概要
ウイルス除去・不活化のために、以下の安全対策が組み込まれています。
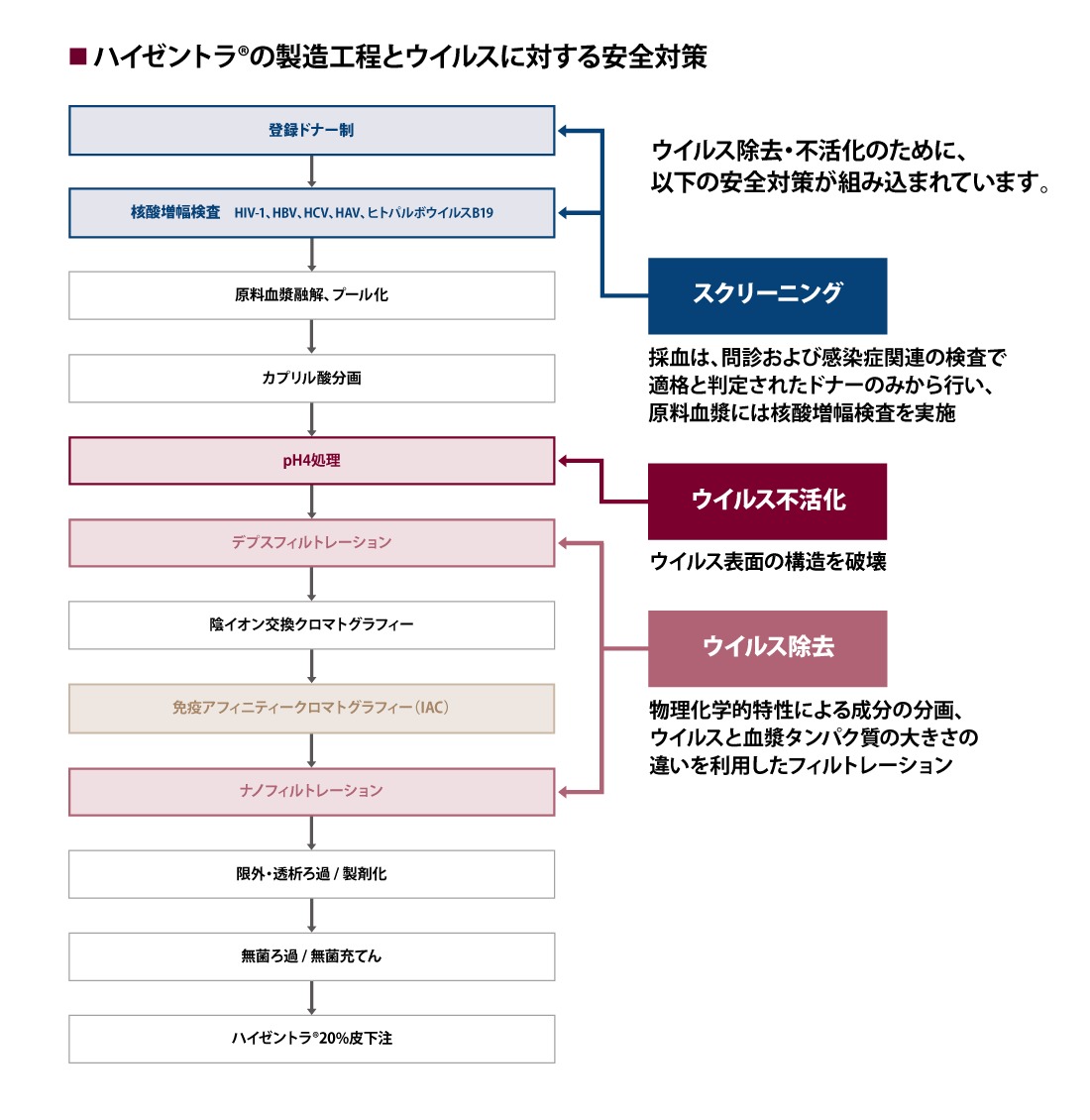
ハイゼントラ製品電子添文 2024年8月改訂(第3版)
Gerber S, et al.:BioDrugs. 2016;30(5):441-451より作成
ウイルスクリアランス試験
ハイゼントラの製造工程におけるウイルスの除去・不活化を検証するため、モデルウイルスを用いたウイルスクリアランス試験を実施しました。
その結果、以下のウイルスクリアランス能を有することが示されました。
| HIV | PRV | BVDV | WNV | EMCV | MVM | B19V | |
| 総ウイルスクリアランス指数 ( log10 )※ | ≧19.30 | ≧23.65 | ≧17.41 | ≧22.9 | ≧9.29 | ≧7.60 | ≧5.30 |
社内資料(2018年6月時点)
HIV:ヒト免疫不全ウイルス、PRV:仮性狂犬病ウイルス、BVDV:ウシウイルス性下痢ウイルス、WNV:ウエストナイルウイルス、
EMCV:脳心筋炎ウイルス、MVM:マウス微小ウイルス
8. 重要な基本的注意(抜粋)
〈効能共通〉
8.1 本剤の使用にあたっては、疾病の治療における本剤の必要性とともに、本剤の製造に際し感染症の伝播を防止するための安全対策が講じられているが、血液を原材料としていることに由来する感染症伝播のリスクを完全に排除することができないことを患者に対して説明し、理解を得るよう努めること。
8.2 本剤の原材料となる血漿については、HBs抗原、抗HCV抗体、抗HIV-1抗体及び抗HIV-2抗体が陰性であることを確認している。さらに、プールした試験血漿については、HIV-1、HBV、HCV及びHAVについて核酸増幅検査(NAT)を実施し、適合した血漿を本剤の製造に使用しているが、当該NATの検出限界以下のウイルスが混入している可能性が常に存在する。また、ヒトパルボウイルスB19についてもNATによるスクリーニングを実施し、適合した血漿を用いている。
その後の製造工程であるデプスフィルトレーション、pH4処理及びナノフィルトレーションは、HIV、HBV、HCV等のエンベロープを有するウイルス及びエンベロープを有しないHAV、ヒトパルボウイルスB19をはじめとする各種ウイルス除去・不活化効果が確認されているが、投与に際しては、次の点に十分に注意すること。
血漿分画製剤の現在の製造工程では、ヒトパルボウイルスB19等のウイルスを完全に不活化・除去することが困難であるため、本剤の投与によりその感染の可能性を否定できないので、投与後の経過を十分に観察すること。[9.1.4、9.1.5、9.5 参照]
登録ドナーからの採血
- ハイゼントラ®の有効成分である人免疫グロブリンGは自社運営の採血センター(CSLプラズマ)にて採集します。
- CSLプラズマでは登録ドナー制を採用しており、初回ドナーは最長6ヵ月の検疫(クアランティン)期間内に2回の採血を実施し、スクリーニング検査で2回とも陰性である場合に初めて登録ドナーとなります。
- 登録ドナーに繰り返し供血いただくことにより安全性の高い血漿を確保できます。
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対しショックの既往歴のある患者
2.2 高プロリン血症1 型又は2 型の患者[本剤に含有されるプロリンが通常の代謝経路では代謝されないため、血中プロリン濃度が高値になり、症状があらわれることがある。]