臨床試験(PATH継続試験)
「禁忌を含む注意事項等情報」等については、電子添文をご参照ください。
ピリヴィジェンの「禁忌を含む注意事項等情報」等については、電子添文をご参照ください。
国際共同第Ⅲ相継続試験:PATH試験の継続試験(日本人を含む海外データ)4,5)
4)社内資料:臨床概要(臨床的有効性)(PATH試験の継続試験)(承認時評価資料)
5)van Schaik IN, et al: Neurol Neuroimmunol Neuroinflamm. 2019; 6(5): e590
利益相反:本試験はCSLベーリングより資金助成を受けた。著者にCSLベーリングよりコンサルタント料、謝礼、研究費を受領している者が含まれる。
本論文の著者のうち3人はCSLベーリングの社員である。
PATH試験の継続試験では、日本人を含むCIDP患者を対象に、ハイゼントラの長期安全性および有効性を検討しました。
試験概要
目的
ハイゼントラの長期安全性および有効性を検討する。
対象
PATH試験において皮下投与を受けたCIDP患者、または皮下投与期間中にCIDPを再発※しピリヴィジェン救済治療により回復したCIDP患者82例(日本人患者10例を含む)
試験デザイン
多施設共同、非盲検、前向き、第Ⅲ相継続試験
方法
本試験は、治験実施計画書(初版)と治験実施計画書(改訂1以降)では、PATH試験からの組み入れ要件やハイゼントラの投与方法が異なる。
82例のうち、63例(76.8%)は治験実施計画書(初版)で、19例(23.2%)は治験実施計画書(改訂1以降)で組み入れた。
[治験実施計画書(初版)]
本試験への移行後、最初にハイゼントラ0.4g/kg体重を24週間投与し、25週時に0.2g/kg体重に切り替えた。
CIDPが再発した場合、0.2g/kg体重の投与を受けていた被験者は、0.4g/kg体重に増量して試験を継続、または試験の中止のいずれかを選択することができた。
[治験実施計画書(改訂1以降)]
ハイゼントラ0.2g/kg体重で投与を開始し、CIDP再発が認められない場合は、試験期間中0.2g/kg体重の投与を継続した。CIDPが再発した場合、0.4g/kg体重に増量して試験を継続、または試験の中止のいずれかを選択することができた。
投与方法
体重に基づいてハイゼントラを週1回投与した。
用量が0.2g/kg体重の場合は1回で投与し、0.4g/kg体重の場合は2回に分けて、1日または2日(連日)かけて投与した。
評価項目
[安全性評価項目]
有害事象、曝露量、投与データ、臨床検査項目、ウイルス安全性、身体検査および心電図(日本のみ)
[有効性評価項目]
INCATスコア、R-ODSパーセンタイルスコア、平均握力およびMRC合計スコア、CIDPの再発率
[探索的評価項目]
健康関連QOL評価(EQ-5D、TSQM、WPAI-GH、被験者の治療の選好に関する質問票)、血清中IgG濃度
解析計画
[安全性評価項目]
安全性の解析対象集団は、ハイゼントラの投与を1回以上受けた全被験者集団のすべての被験者を対象とした安全性解析対象集団とし、いずれかの用量での投与を1回以上受けた被験者を当該投与群に割り付けた。
有害事象は被験者数に基づき解析し、発現頻度および発現率を算出した。曝露量、臨床検査値、投与データ、バイタルサインおよびウイルス学的検査を要約した。
[有効性評価項目]
有効性の解析対象集団は、試験に組み入れられたすべての被験者を対象とした全被験者集団とした。
INCATスコア、R-ODSパーセンタイルスコア、平均握力(利き手および非利き手)、MRC合計スコアは、記述統計を用いて投与群別および試験来院別に要約した。
[サブグループ解析]
安全性について、日本人集団に発現した有害事象をサブグループ解析として実施した。
※CIDPの再発:
ベースライン(ピリヴィジェン 再安定化期間の試験終了来院時)と比較して、INCATスコアが1ポイント以上増加した場合(上肢スコアが0から1に増加したINCATスコアの1ポイント増加は除く)、または上肢スコアが1から0に減少し、下肢スコアが1ポイント増加したためINCATスコアが不変の場合。
CIDP:chronic inflammatory demyelinating polyneuropathy、INCAT:Inflammatory Neuropathy Cause and Treatment、 R-ODS:Rasch-built Overall Disability Scale、MRC:Medical Research Council、EQ-5D:EuroQoL 5-Dimension Questionnarie、TSQM:Treatment Satisfaction Questionnaire for Medication、WPAI-GH:Work Productivity and Activity Impairment Questionnaire for General Health、IgG:immunogloblin G
患者背景
対象患者の平均年齢は57.6歳、男性50例(61.0%)、平均体重は80.2kg、平均BMI は26.7kg/m2でした4,5)。INCATスコア平均値は2.6、MRC合計スコア中央値は76、R-ODSパーセンタイルスコア中央値は65、利き手の握力中央値は67kPaでした4,5)。継続試験開始時の初回用量は0.2g/kg体重が20例、0.4g/kg体重が62例でした4,5)。
患者背景
| 全体 (N=82) | 日本人 (N=10) | ||
| 年齢、歳 | 平均値(SD) | 57.6(13.22) | 49.1(13.29) |
| 中央値(範囲) | 57.23(28.2~83.4) | 48.45(32.2~71.9) | |
| 年齢層、n(%) | 18歳以上、65歳以下 | 55(67.1) | 8(80.0) |
| 65歳超 | 27(32.9) | 2(20.0) | |
| 性別、n(%) | 男性 | 50(61.0) | 4(40.0) |
| 女性 | 32(39.0) | 6(60.0) | |
| 人種、n(%) | 白人 | 70(85.4) | 0 |
| アジア人 | 10(12.2) | 10(100.0) | |
| 日本人 | 10(12.2) | 10(100.0) | |
| その他 | 2(2.4) | 0 | |
| 体重、kg | 平均値(SD) | 80.2(18.89) | 57.7(10.27) |
| 中央値(範囲) | 80.00(42.1~135.1) | 57.40(42.1~73.9) | |
| BMIa、b)、kg/m2 | 平均値(SD) | 26.7(4.52) | 22.8(3.41) |
| 中央値(範囲) | 26.85(18.0~40.8) | 21.75(18.6~27.9) | |
| ベースライン時のINCATスコア | 平均値(SD) | 2.6(1.84) | 1.1(1.45) |
a)ベースライン時点のBMI=ベースライン時点の体重(kg)/(PATH試験のスクリーニング時点の身長[m])2
b)全体 n=81、日本人 n=10
INCATスコア:
INCATスコアは、上肢と下肢の機能を0(正常)~10(上肢または下肢での目的を持った動きが不可能)で評価する尺度である。
調整INCATスコアとは、上肢機能の0(正常)から1(軽微な症状)または1から0への変化は、臨床的に意義がないとの判断により、悪化または改善として記録しないスコアのことである。
安全性
副作用4,5)
[全体]
有害事象発現率は、ハイゼントラ0.2g/kg体重群45.2%(33/73例)、0.4g/kg体重群63.9%(46/72例)でした。
副作用発現率は、ハイゼントラ0.2g/kg体重群で11.0%(8/73例)、0.4g/kg体重群で23.6%(17/72例)でした。
主な副作用は、注入部位腫脹11.0%(9/82例)、注入部位紅斑8.5%(7/82例)、注入部位疼痛3.7%(3/82例)などでした。
重篤な有害事象は、ハイゼントラ0.2g/kg体重群で4例(胆嚢穿孔が1例、心房粗動が1例、神経圧迫が1例、心房粗動および肺敗血症が1例)、0.4g/kg体重群で3例(尿路感染が1例、糞塊が1例、CIDP再発が1例)に認められました。
投与中止に至った有害事象は、ハイゼントラ0.2g/kg体重群2例(心房粗動が1例、注入部位腫脹および注入部位紅斑が1例)、0.4g/kg体重群1例(注入部位腫脹、注入部位紅斑および発熱が1例)に認められました。
試験期間中に死亡例は認められませんでした。
有効性
継続試験におけるCIDPの再発率は、0.2g/kg体重群47.9%(35/73例)、0.4g/kg体重群 9.7%(7/72例)、全体で50.0%(41/82例)でした4,5)。
また、初回用量0.4g/kg体重から0.2g/kg体重に減量した52例中26例(50.0%)に再発が認められましたが、0.4g/kg体重に再び増量することで26例中24例(92.3%)に再発からの回復が認められました4,5)。
CIDPの再発率
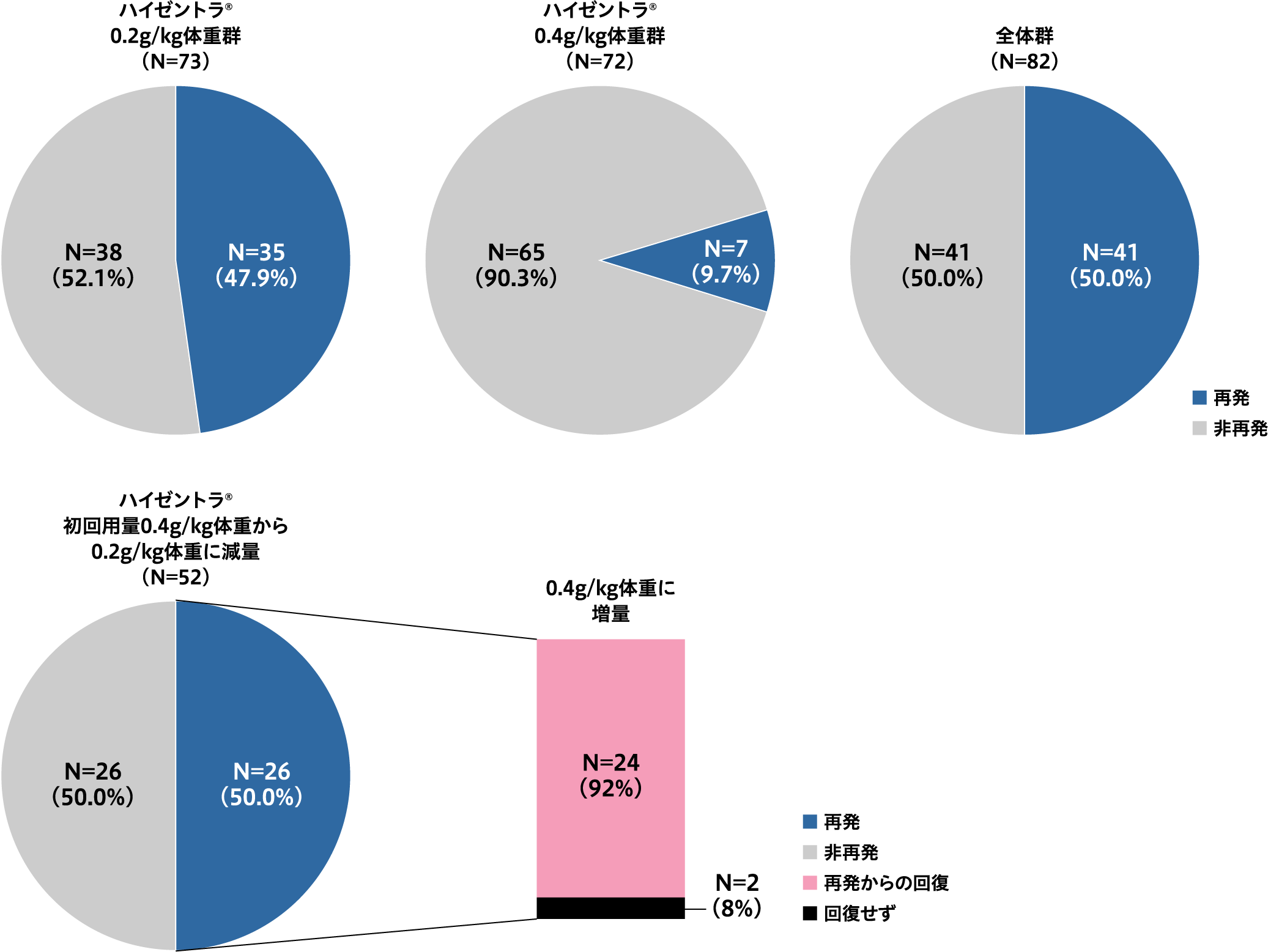
注1:再発率は、PATH試験終了時の治療状況に関わらず、継続試験の全被験者から算出した。再発および非再発はPATH試験の主要評価項目に基づいて定義した。
注2:0.2g/kg体重の投与を1回以上受けた被験者は0.2g/kg体重群、0.4g/kg体重の投与を1回以上受けた被験者は0.4g/kg体重群に割り付けた。このため、該当する被験者はいずれの投与群でも集計されている。
4,5)より作図
MRC合計スコアのベースライン時および再発時のベースラインからの変化量は、0.2g/kg体重群ではベースライン時76.0、再発時の変化量-3.0、0.4g/kg体重群ではベースライン時76.0、再発時の変化量-8.0でした4,5)。
RODSパーセンタイルスコアは、0.2g/kg体重群ではベースライン時65.0、再発時の変化量-8.0、0.4g/kg体重群では、ベースライン時65.0、再発時の変化量-13.0でした。利き手の握力は、0.2g/kg体重群ではベースライン時68.7kPa、再発時の変化量-6.3kPa、0.4g/kg体重群では、ベースライン時66.0kPa、再発時の変化量-12.0kPaでした(数値はいずれも中央値)4,5)。
MRC合計スコア、RODSパーセンタイルスコア、利き手の握力のベースラインから再発時の変化量
| MRC合計スコア | ハイゼントラ 0.2g/kg体重群 (N=73) | ハイゼントラ 0.4g/kg体重群 (N=72) | 全体 (N=82) | |
| ベースライン時 | N | 71 | 69 | 78 |
| 中央値(範囲) | 76.0(47~80) | 76.0(47~80) | 76.0(47~80) | |
| 再発時a) | N | 35 | 7 | 40 |
| ベースラインからの変化量、中央値(範囲) | -3.0(-16~6) | -8.0(-23~0) | -3.5(-16~6) | |
| 再発後4週時点b) | N | 32 | 4 | 36 |
| ベースラインからの変化量、中央値(範囲) | 0.0(-16~8) | -7.5(-20~0) | 0.0(-20~8) | |
| 最終観察時点 | N | 70 | 69 | 78 |
| ベースラインからの変化量、中央値(範囲) | -1.0(-20~18) | 0.0(-23~19) | 0.0(-23~18) | |
| 非再発例c) | N | 35 | 29 | 38 |
| ベースラインからの変化量、中央値(範囲) | 0.0(-7~18) | 0.0(-4~19) | 0.0(-7~18) | |
| R-ODSパーセンタイルスコア | ハイゼントラ 0.2g/kg体重群 (N=73) | ハイゼントラ 0.4g/kg体重群 (N=72) | 全体 (N=82) | |
| ベースライン時 | N | 64 | 62 | 71 |
| 中央値(範囲) | 65.0(19~100) | 65.0(19~100) | 65.0(19~100) | |
| 再発時a) | N | 33 | 7 | 39 |
| ベースラインからの変化量、中央値(範囲) | -8.0(-50~9) | -13.0(-58~8) | -8.0(-50~9) | |
| 再発後4週時点b) | N | 30 | 3 | 33 |
| ベースラインからの変化量、中央値(範囲) | -0.5(-37~21) | -2.0(-5~0) | -1.0(-37~21) | |
| 最終観察時点 | N | 63 | 62 | 71 |
| ベースラインからの変化量、中央値(範囲) | -3.0(-50~9) | 0.0(-76~33) | 0.0(-76~33) | |
| 非再発例c) | N | 28 | 22 | 31 |
| ベースラインからの変化量、中央値(範囲) | 0.0(-35~9) | 0.0(-12~28) | 0.0(-12~12) | |
| 握力(利き手) | ハイゼントラ 0.2g/kg体重群 (N=73) | ハイゼントラ 0.4g/kg体重群 (N=72) | 全体 (N=82) | |
| ベースライン時 | N | 71 | 70 | 79 |
| 中央値(範囲) | 68.7(8~157) | 66.0(8~157) | 66.7(8~157) | |
| 再発時a) | N | 34 | 7 | 40 |
| ベースラインからの変化量、中央値(範囲) | -6.3(-71~21) | -12.0(-80~5) | -6.8(-71~21) | |
| 再発後4週時点b) | N | 32 | 4 | 36 |
| ベースラインからの変化量、中央値(範囲) | -0.7(-59~21) | -8.7(-9~14) | -1.2(-59~21) | |
| 最終観察時点 | N | 70 | 70 | 79 |
| ベースラインからの変化量、中央値(範囲) | -3.7(-71~21) | 0.7(-80~27) | 0.7(-80~27) | |
| 非再発例c) | N | 35 | 30 | 39 |
| ベースラインからの変化量、中央値(範囲) | 0.7(-43~21) | 1.0(-32~21) | 0.0(-43~21) | |
b)再発前の治療に基づく。
c)試験期間中、再発が認められなかった被験者を含む。
注:0.2g/kg体重の投与を1回以上受けた被験者は0.2g/kg体重群、0.4g/kg体重の投与を1回以上受けた被験者は0.4g/kg体重群に割り付けた。このため、該当する被験者はいずれの投与群でも集計されている。
[参考情報]
被験者の治療の選好4,5)
※被験者は、PATH試験および継続試験の登録へ同意しており、SCIG治療を選好している可能性があることに留意が必要である。
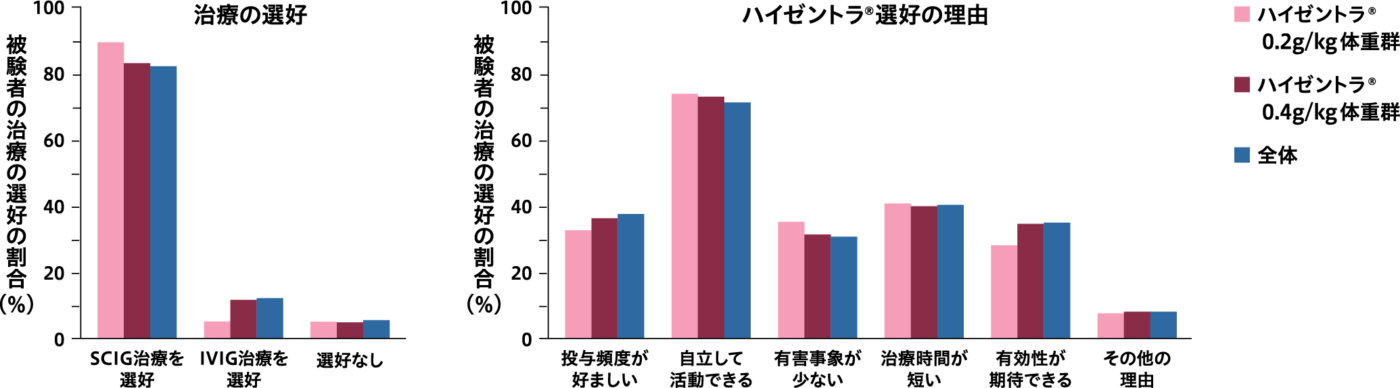
注:0.2g/kg体重の投与を1回以上受けた被験者は0.2g/kg体重群、0.4g/kg体重の投与を1回以上受けた被験者は0.4g/kg体重群に割り付けた。 このため、該当する被験者はいずれの投与群でも集計されている。
4,5)より作図
ハイゼントラの6. 用法及び用量(抜粋)
- 〈慢性炎症性脱髄性多発根神経炎の運動機能低下の進行抑制(筋力低下の改善が認められた場合)〉
通常、成人には人免疫グロブリンGとして1週あたり200mg(1mL)/kg体重を1日または連続する2日で分割して皮下投与するが、患者の状態に応じて、最大400mg(2mL)/kg体重から投与を開始することもできる。 なお、維持用量は200〜400mg/kg体重で適宜増減する。