開発の経緯
血友病B[血液凝固第IX因子(factor IX:FIX)欠乏症]は、X染色体連鎖劣性遺伝性の出血性疾患であり、FIXタンパク質の欠損又は機能低下により生じる希少疾患である。FIXを補充することでFIXレベルを上昇させ、血液凝固因子の欠乏を一時的に補正し、出血を予防する補充療法が標準的な治療方法である。FIX製剤による定期的な投与(定期補充療法)は、血液凝固因子レベルを一定以上に保つことで、自然出血を防ぎ、関節症の予防が期待できるが、FIX活性の「トラフ値を1%以上に維持すること」が血友病の重症度を下げ、後遺症や合併症を予防するために重要であった。
FIX製剤は定期補充療法及び周術期を含む出血エピソードに対する急性期の治療に適応されているが、頻回注射による患者負担を軽減するために、投与間隔を長くしても高いFIX活性トラフ値を維持でき、効果が持続するFIX補充製剤が望まれていた。
イデルビオン静注用[一般名:アルブトレペノナコグ アルファ(遺伝子組換え)]は、米国CSLベーリング社が静脈内投与の頻度を7~14日間に1回まで減らすことを目的として開発した遺伝子組換え血液凝固第IX因子アルブミン融合タンパク質(recombinant coagulation factor IX albumin fusion protein:rIX-FP)であり、ヒトのFIXのシーケンスに由来するショートリンカーにより遺伝子組換えヒトアルブミンと遺伝子組換えヒトFIXを結合させた構成を有している。
イデルビオンは、ウイルス試験、細胞培養工程における動物の血清成分を含まない培地の使用、ウイルス除去工程を経て製造することで高水準のウイルス安全性を保証している。
本剤の臨床開発プログラムでは、成人及び小児の血友病B患者(FIX活性2%以下)を対象として5試験が実施された。日本人への投与は、国際共同第Ⅱ/Ⅲ相試験(3001試験)及び第Ⅲb相継続試験(3003試験、継続中)において実施された。
その結果、良好な薬物動態(PK)プロファイルが示されるとともに、より長い投与間隔(7日又は14日に1回)での定期補充療法、周術期の確実な出血抑制及び止血管理、並びに急性期出血時の止血において、本剤の安全性と有効性が検証されたことから、「血液凝固第IX因子欠乏患者における出血傾向の抑制」を効能又は効果として2016年9月に承認を取得した。なお、2016年1月にカナダ、同年3月に米国、さらに5月に欧州で成人及び小児血友病B患者に対する適応として承認を取得した。
血友病B患者を対象とした国際共同第Ⅲb相継続試験(3003試験)において100 IU/kgを21日に1回で投与する用法・用量の有効性及び安全性が検証されたことから、用法・用量として、100 IU/kgの21日に1回の投与方法が追加され、2020年8月に承認を取得した。
JPN-AFS-1834
2024年6月改訂
製品特徴
- 遺伝子組換えヒトアルブミンと遺伝子組換えFIXの融合により血中半減期を延長させた。
- 血中半減期は104時間、AUC0-infは7,482 IU×時間/dLを示した※1。
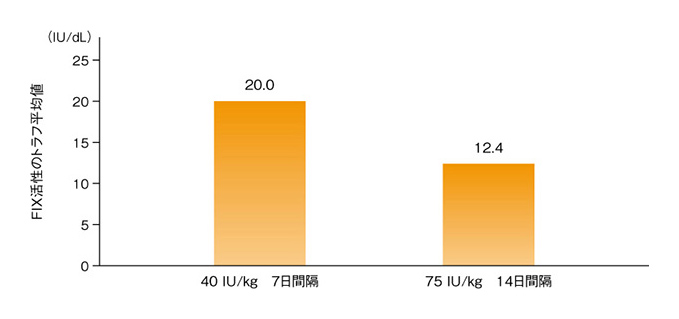
- FIX活性トラフ平均値は、40 IU/kgを7日ごとに1回投与で20.0 IU/dL、75 IU/kgを14日ごとに1回投与で12.4 IU/dLであった※2。
- 定期補充療法による年間出血回数[自然出血(AsBR)及び関節内出血]の中央値はいずれも0であった※2。
- 小児患者(12歳未満)の定期補充療法におけるAsBRの中央値は0であった※3。
- 治療を要した出血エピソードに対する治療成功確率*は、98.6%及び97.2%(小児患者)であった※2、3。
*:1~2回の投与で止血を得られる確率
- 周術期止血管理に対し、治験責任医師が評価した止血効果は、全ての手術で「著効」又は「有効」であった※2、3。
- 重大な副作用として、ショック、アナフィラキシー(いずれも頻度不明)、血栓塞栓症(頻度不明)があらわれることがある。主な副作用として浮動性めまい、頭痛(1~2%未満)、過敏症、発疹、湿疹(1%未満)、インヒビターの発現(頻度不明)が報告されている(詳細については、電子添文の副作用及び臨床成績の安全性の結果を参照)。
イデルビオン電子添文 2024年3月改訂(第2版)より作成
※1:18~65歳の血友病B患者における統合PK解析
※2:12~65歳の重症(FIX活性≦2%)血友病B患者を対象とした国際多施設共同非盲検第Ⅱ/Ⅲ相試験
※3:12歳未満の重症(FIX活性≦2%)血友病B患者を対象とした国際多施設共同非盲検第Ⅲ相試験
JPN-AFS-1834
2024年6月改訂
作用機序
血液凝固第IX因子の役割とイデルビオンの作用点
血液凝固第IX因子(FIX)は肝臓で産生されるタンパク質であり、内因系及び外因系の両凝固経路において止血栓形成に極めて重要である。上流の血液凝固因子[外因系経路では活性化第VII因子/組織因子(FVIIa/TF)複合体、内因系経路では活性化第XI因子(FXIa)]により活性化されたFIX(FIXa)は、血液凝固第Ⅹ因子(FⅩ)を活性化する。これらの血液凝固カスケードの結果、最終的にプロトロンビンがトロンビンに変換され、トロンビンがフィブリノゲンをフィブリンに転換して止血栓を形成する。
イデルビオン(一般名:アルブトレペノナコグ アルファ)は、チャイニーズハムスター卵巣(CHO)細胞で産生される高度に精製された遺伝子組換えヒトアルブミン融合型のヒト遺伝子組換え血液凝固第IX因子であり、長い血中半減期と高いFIX活性の維持を可能とした。アルブミンは血漿中に最も多く含まれるタンパク質で、血中半減期が長い(約20日)ことが知られている1、2)。アルブミンは細胞内に取り込まれた後、胎児性Fcレセプター(FcRn)に結合することで、リソソームによる分解を防ぎ、血管内に再循環される。イデルビオンはこの再循環経路を利用し、アルブミンと融合することにより血中半減期を延長している1、2)。また、イデルビオンのFIX部分とアルブミン部分の切断部位であるリンカーは、ヒトのFIX活性化に関与する活性化ペプチドに由来しており、出血時、上流の血液凝固因子によりFIXの活性化とアルブミンの切断が同時に起こる3)。
このように、イデルビオンはFIX機能が欠乏又は低下した患者の血漿中FIXレベルを上昇させ、血液凝固障害を改善することが可能である。
イデルビオンの作用機序
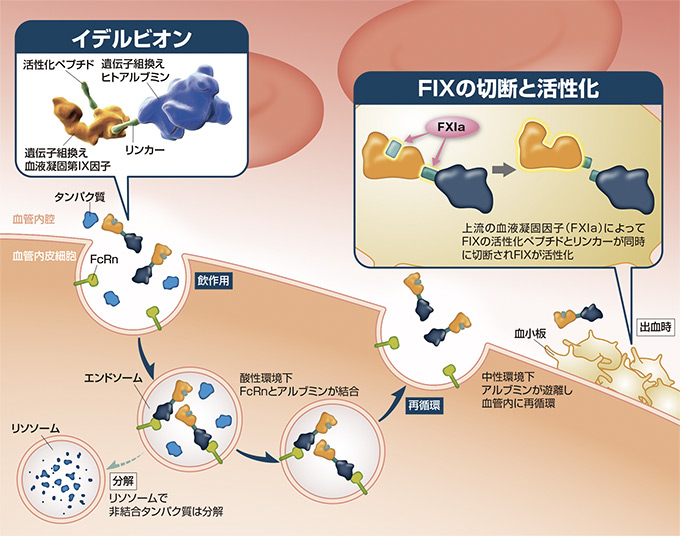
FcRn:胎児性Fcレセプター、 FIX:血液凝固第IX因子、 FXIa:活性化血液凝固第XI因子
リンカー:FIXの活性化ペプチドのアミノ酸配列に由来
- Metzner HJ et al.: Thromb Haemost. 2013; 110(5): 931-939
本研究はCSLベーリングの支援により行われ、本論文著者のうち1名はCSLベーリングから講演料、コンサルタント料などを受け取っており、本論文著者のうち3名はCSLベーリングの社員である。 - Schulte S.: Thromb Res. 2013; 131: S2-S6
本論文著者はCSLベーリングの社員である。 - Metzner HJ et al.: Thromb Haemost. 2009; 102(4): 634-644
本論文著者は全てCSLベーリングの社員である。
JPN-AFS-1834
2024年6月改訂
薬物動態
1.単回投与後の薬物動態評価
(1)イデルビオン50 IU/kg単回投与後の薬物動態評価(日本人及び外国人データ:統合PK解析、母集団PK解析)1、2)
18~65歳の血友病B患者を対象に、イデルビオン50 IU/kg単回投与後の全集団(日本人を含む)及び日本人患者の薬物動態パラメータを下表に示す。
全集団におけるイデルビオンの回収率(IR)は1.3(IU/dL)/(IU/kg)、半減期(t1/2)は104.2時間、クリアランス(CL)は0.73mL/時間/kgであった。
イデルビオン50 IU/kg単回投与後のFIX活性の薬物動態パラメータ(成人:18~65歳)
| パラメータ | イデルビオン50 IU/kg | rFIXa50 IU/kg (N=15) | |
|---|---|---|---|
| 全集団(N=47) | 日本人(N=10) | ||
| IR[(IU/dL)/(IU/kg)] | 1.3(23.8) | 1.3(36.7) | 0.9(22.0) |
| Cmax(IU/dL) | 66.6(26.7) | 63.9(35.3) | 45.2(22.0) |
| AUC0-inf(IU×時間/dL) | 7,481.7(28.4) | 6,684.9(28.3) | 1,396.4(25.1) |
| t1/2(時間) | 104.2(25.4) | 94.6(19.9) | 23.4(19.0) |
| MRT(時間) | 143(22.7) | 133(16.9) | 34.2(19.8) |
| CL(mL/時間/kg) | 0.7(26.8) | 0.8(27.2) | 3.8(26.8) |
| VSS(dL/kg) | 1.0(27.9) | 1.0(15.0) | 1.3(20.6) |
| 1%に達する期間(日)b | 23(19.5) | - | - |
| 3%に達する期間(日)b | 16(13.0) | - | - |
| 5%に達する期間(日)b | 13(10.5) | - | - |
測定方法:シリカを含むaPTT試薬を用いた凝固一段法による中央測定、IR(回収率):投与量(IU/kg)当たりの投与後30分の上昇値、Cmax:最高血中濃度、AUC:血液凝固第IX因子活性‐時間曲線下面積、t1/2:血中半減期、MRT:平均滞留時間、CL:クリアランス値、VSS:定常状態分布容積、a:従来使用していた遺伝子組換え血液凝固第IX因子製剤、b:FIX活性中央値が所定の活性(%)上昇を維持した推定期間、中央値(第1四分位値)
【対象及び方法】
イデルビオンの承認時臨床試験に参加した血友病B[血液凝固第IX因子(FIX)活性≦2%]患者を対象に、イデルビオン25、50又は75 IU/kgの少なくとも1用量のPK評価を行い、これらのPKデータを用いて統合PK解析(ノンコンパートメント解析)を行った。さらに、統合PKデータについて1~61歳の患者計104例から得られた2,555測定点でのFIX活性データを使用し、母集団PK解析を行った。FIX活性は、体重及び体重で調整した用量のみを有意な共変量とした2-コンパートメント母集団PKモデルとした。
(2)イデルビオン100 IU/kg単回投与後の薬物動態評価(日本人及び外国人データ:国際共同第Ⅲb相継続試験)3)
18歳以上の血友病B患者を対象に、イデルビオン100 IU/kg単回投与後の全集団(日本人を含む)及び日本人患者の薬物動態パラメータを下表に示す。
全集団におけるイデルビオンの回収率(IR)は100 IU/kg群において1.0(IU/dL)/(IU/kg)、半減期(t1/2)は143.2時間であった。
イデルビオン100 IU/kg単回投与後のFIX活性の薬物動態パラメータ(18歳以上)
| パラメータ | 全集団 (N=16) | 日本人 (N=3) |
|---|---|---|
| IR[(IU/dL)/(IU/kg)] | 1.0(12.6) | 0.9(6.6) |
| Cmax(IU/dL) | 102.2(12.6) | 88.5(8.5) |
| AUC0-inf(IU×時間/dL) | 17,068.4(19.2) | 16,420.2(5.2) |
| t1/2(時間) | 143.2(26.1) | 144.2(17.0) |
| VSS(dL/kg) | 1.1(10.7) | 1.2(10.5) |
測定方法:シリカを含むaPTT試薬を用いた凝固一段法による中央測定、IR(回収率):投与量(IU/kg)当たりの投与後30分の上昇値、Cmax:最高血中濃度、AUC:血液凝固第IX因子活性‐時間曲線下面積、t1/2:血中半減期、VSS:定常状態分布容積
【対象及び方法】
日本人3例を含む血友病B[血液凝固第IX因子(FIX)活性≦2%]患者16例を対象に、イデルビオン100 IU/kgを投与しPK評価を実施した。FIX活性についてはノンコンパートメント解析を用いて評価した。
2.反復投与後の薬物動態評価(日本人及び外国人データ)4)
イデルビオン50 IU/kg投与後の初回薬物動態評価時と、約6ヵ月後(定期補充療法が約6ヵ月間行われた後)の再評価時において、各薬物動態パラメータの値は以下のとおりであった。
イデルビオン50 IU/kgの初回及び6ヵ月間反復投与後のFIX活性薬物動態パラメータ
| パラメータ | 50 IU/kg初回 (N=14) | 50 IU/kg反復 (N=15) |
|---|---|---|
| IR[(IU/dL)/(IU/kg)] | 1.3(16.7) | 1.4(19.5) |
| Cmax(IU/dL) | 64.7(15.8) | 71.0(19.4) |
| AUC0-inf(IU×時間/dL) | 7,904(23) | 9,979(25) |
| t1/2(時間) | 112(15.1) | 128(26.8) |
| MRT(時間) | 156(15.2) | 172(25.7) |
| CL(mL/時間/kg) | 0.7(24.5) | NC |
| VSS(dL/kg) | 1.0(17.4) | 1.4(23.8) |
測定方法:シリカを含むaPTT試薬を用いた凝固一段法による中央測定、IR(回収率):投与量(IU/kg)当たりの投与後30分の上昇値、Cmax:最高血中濃度、AUC:血液凝固第IX因子活性‐時間曲線下面積、t1/2:血中半減期、MRT:平均滞留時間、CL:クリアランス値、VSS:定常状態分布容積、NC:算出せず
【対象及び方法】
18~65歳(1例12歳)の血友病B[血液凝固第IX因子(FIX)活性≦2%]患者15例を対象に、イデルビオン50 IU/kgを投与し初回PK評価を実施した。次いで、イデルビオン50 IU/kgによる定期補充療法を約6ヵ月間実施したのち、再度PK評価を行った。
3.小児患者の薬物動態評価(外国人データ:統合PK解析、母集団PK解析)1、2)
イデルビオン50 IU/kg単回投与後の薬物動態パラメータは以下のとおりであった。なお、イデルビオン50 IU/kg単回投与後のFIX活性は、0~6歳未満及び6~12歳未満のいずれの年齢層でも14日目においても2 IU/dL以上を維持していた。
イデルビオン50 IU/kg単回投与後のFIX活性の薬物動態パラメータ
| パラメータ | 0~6歳未満 (N=12) | 6~12歳未満 (N=15) | 12~18歳未満 (N=8) |
|---|---|---|---|
| IR[(IU/dL)/(IU/kg)] | 1.0(21.5) | 1.1(22.6) | 1.1(27.7) |
| Cmax(IU/dL) | 48.3(19.0) | 52.9(23.2) | 55.3(28.1) |
| AUC0-inf(IU×時間/dL) | 4,582.6(33.2) | 5,123.1(31.4) | 5,347.1(48.2) |
| t1/2(時間) | 89.6(12.5) | 92.8(20.5) | 87.3(35.7) |
| MRT(時間) | 123(14.2) | 129(19.0) | 119(31.2) |
| CL(mL/時間/kg) | 1.2(27.8) | 1.1(28.5) | 1.1(39.3) |
| VSS(dL/kg) | 1.4(24.1) | 1.3(19.7) | 1.2(14.0) |
| 1%に達する期間(日)a | 14(11.5) | 17(14.5) | 21(17.5) |
| 3%に達する期間(日)a | 9(7.5) | 12(9.5) | 14(12.5) |
| 5%に達する期間(日)a | 7(6.0) | 9(7.5) | 11(9.5) |
測定方法:シリカを含むaPTT試薬を用いた凝固一段法による中央測定、IR(回収率):投与量(IU/kg)当たりの投与後30分の上昇値、Cmax:最高血中濃度、AUC:血液凝固第IX因子活性‐時間曲線下面積、t1/2:血中半減期、MRT:平均滞留時間、CL:クリアランス値、VSS:定常状態分布容積、a:FIX活性中央値が所定の活性(%)上昇を維持した推定期間、中央値(第1四分位値)
【対象及び方法】
イデルビオンの承認時臨床試験に参加した血友病B[血液凝固第IX因子(FIX)活性≦2%]患者を対象に、イデルビオン25、50又は75 IU/kgの少なくとも1用量のPK評価を行い、これらのPKデータを用いて統合PK解析(ノンコンパートメント解析)を行った。さらに、統合PKデータについて1~61歳の患者計104例から得られた2,555測定点でのFIX活性データを使用し、母集団PK解析を行った。FIX活性は、体重及び体重で調整した用量のみを有意な共変量とした2-コンパートメント母集団PKモデルとした。
4.分布(日本人及び外国人データ)5)
アルブトレペノナコグ アルファの分布容積(VSS)は、血液量(体重の7.7%)と比較して、約1dL/kg又は体重の10%であった。
<参考>臓器内分布(ラット)6)
標識したアルブトレペノナコグ アルファ([3H]-rIX-FP)を約400µCi/kg、雄性ラットに静脈内投与した際、副腎、脾臓、肺、肝臓、腎臓、心筋、歯根膜、鼻粘膜、胃壁及び胃腸粘膜を含む、主に血管の豊富な組織及び排泄器官へ移行した。骨髄及び膝関節部の滑膜又は鉱質化部位にも迅速に存在し、長骨の成長板部位中の石灰化軟骨帯に大部分が局在すると考えられた。最長滞留時間は骨髄及び長骨の骨内膜で観察された。この所見はアルブミン融合に依存しないことが示唆された。[3H]-rIX-FP及び[3H]-アルブミン由来の放射能は120時間まで測定可能であった。
5.代謝(日本人及び外国人データ)5)
アルブトレペノナコグ アルファは遺伝子組換えタンパク質であり、内在性FIXと同じ異化経路をたどるため、FIX断片及びアルブミン断片両方ともに同じアミノ酸断片となる。
6.排泄(日本人及び外国人データ)5)
アルブトレペノナコグ アルファ(rIX-FP)のFIX及びアルブミンは内在性タンパク質であるため、放射線標識したrIX-FPを用いた検討は実施しなかった。アルブミンはFIXに融合し、またアルブミン自身が胎児性Fcレセプター(FcRn)※に結合していることから、rIX-FPの分解が抑制され、その結果FIXのt1/2が延長する。
※胎児性Fcレセプター(neonatal Fc receptor):
血漿中から細胞内に取り込まれたIgG抗体に結合することで、IgG抗体の細胞内リソソームによる分解を回避する。また、細胞内から血漿中へのIgGのくみ出しも担う。
<参考>排泄(ラット)6)
標識したアルブトレペノナコグ アルファ([3H]-rIX-FP)を約400µCi/kg、雄性ラットに静脈内投与した際、主として尿経由で消失し、投与240時間後、放射能の73%は尿中から回収され(低分子量成分のみ関連)、糞中に≦5%が消失し、約20%は組織中に存在した。
1)社内資料:統合PK解析(承認時評価資料)
2)社内資料:母集団PK解析(承認時評価資料)
3)社内資料:日本人を含む国際多施設共同非盲検第Ⅲb相継続試験(3003試験)(承認時評価資料)
4)社内資料:日本人を含む国際多施設共同非盲検第Ⅱ/Ⅲ相試験(3002試験)(承認時評価資料)
5)社内資料:薬物動態試験の概要(承認時評価資料)
6)社内資料:ラットを用いたタンパク標識化及び代謝(組織分布又は排泄)試験(承認時評価資料)
JPN-AFS-1834
2024年6月改訂
薬効薬理 臨床薬理試験
(1)定期補充療法による血漿中FIX活性トラフ値(国際共同試験)1)
イデルビオン40 IU/kgを7日に1回、又は75 IU/kgを14日に1回投与したときの、イデルビオンのFIX活性トラフ平均値(Q1、Q3)は、それぞれ20.0(17、26) IU/dL及び12.4(10、14) IU/dLであった。
定期補充療法中のFIX活性トラフ平均値
【対象及び方法】
日本人10例を含む血友病B[血液凝固第IX因子(FIX)活性≦2%]患者63例を対象に、イデルビオンを7日間隔で26週間以上投与した後、投与間隔を10日又は14日間隔に切替え、又は7日間隔を維持しさらに30週間以上投与した。
FIX活性はシリカを含むaPTT試薬を用いた凝固一段法による中央測定により算出し、標準に対する%[100%=1 IU/mL(100 IU/dL)]とした。
(2)投与レジメン別の血漿中FIX活性トラフ値(国際共同試験)2)
FIX活性トラフ値の中央値(範囲)は、7日間隔で22.05(12.5、47.7)%、14日間隔で13.20(3.2、40.1)%、21日間隔で7.70(3.9、11.0)%であった。
18歳以上における投与レジメン別のFIX活性トラフ値(%)の中央値(範囲)
| 全集団 | 日本人 | |||
|---|---|---|---|---|
| 用法・用量 | 例数a | 中央値(範囲) | 例数a | 中央値(範囲) |
| 25~50 IU/kg 7日間隔 | 6 | 22.05 (12.5、47.7) | 3 | 18.10 (12.5、27.4) |
| 75 IU/kg 14日間隔 | 25 | 13.20 (3.2、40.1) | 3 | 7.80 (3.2、14.8) |
| 100 IU/kg 21日間隔 | 6 | 7.70 (3.9、11.0) | 3 | 7.70 (4.6、10.8) |
【対象及び方法】
日本人9例を含む血友病B[血液凝固第IX因子(FIX)活性≦2%]患者83例を対象に、イデルビオンを最初の6ヵ月間は7日間隔、10日間隔*又は14日間隔投与とし、その後は6ヵ月ごとの追跡評価時点で投与間隔を7日間隔、10日間隔*、14日間隔又は21日間隔投与に切替え、30ヵ月以上又はイデルビオンの累積投与日数が100日以上となる期間投与を継続した。FIX活性トラフ値は投与前に採取した血液検体を用いて測定した。*:本邦未承認
(3)投与レジメン別の定常状態での血漿中FIX活性(国際共同試験)3)
定常状態でのFIX活性トラフ値の平均値(SD)は 、7日間隔で22.0(8.4)%、14日間隔で13.6(6.4)%、21日間隔で7.6(2.3)%であった。
投与レジメン別の定常状態のFIX活性トラフ値(%)
| レジメン | 7日間隔 | 14日間隔 | 21日間隔※ |
|---|---|---|---|
| 被験者数(測定回数) | 5(17) | 24(50) | 6(16) |
| 平均値(SD) | 22.0(8.4) | 13.6(6.4) | 7.6(2.3) |
| 中央値(最小、最大) | 21.4(12.7、47.7) | 13.1(3.2、40.1) | 7.7(3.9、11.0) |
本研究はCSLベーリングの支援により行われ、本論文著者のうち3名はCSLベーリングから講演料、コンサルタント料などを受け取っており、本論文著者のうち2名はCSLベーリングの社員である。
【対象及び方法】
日本人9例を含む血友病B[血液凝固第IX因子(FIX)活性≦2%]患者83例を対象に、イデルビオンを最初の6ヵ月間は7日間隔、10日間隔*又は14日間隔投与とし、その後は6ヵ月ごとの追跡評価時点で投与間隔を7日間隔、10日間隔*、14日間隔又は21日間隔投与に切替え、30ヵ月以上又はイデルビオンの累積投与日数が100日以上となる期間投与を継続した。FIX活性トラフ値は投与前に採取した血液検体を用いて測定した。定常状態でのFIX活性の評価は、トラフ値(投与レジメンごとに各投与前に採取した血液検体による)に基づいた。*:本邦未承認
(4)血漿中FIX活性の推移(国際共同試験)4)
イデルビオン50 IU/kg単回投与後の平均FIX活性は14日目まで5%以上を維持しており、日本人においても同様の結果が認められた。
単回投与後の血漿中FIX活性の推移
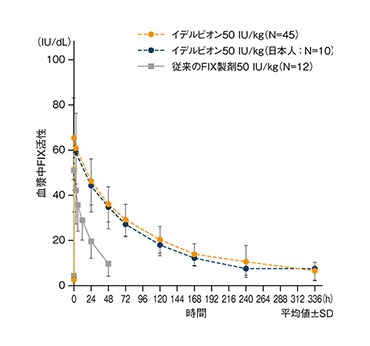
●イデルビオン50 IU/kg単回投与後の FIX活性推移の要約
| (IU/dL) | Day1 (投与前) | Day1 (30分) | Day2 (48時間) |
|---|---|---|---|
| N 平均値(SD) 中央値 (範囲) | 45 2.35(2.55) 1.80 (0.0、14.1) | 45 65.8(15.5) 64.3 (41.2、125) | 40 35.8(7.88) 35.9 (22.1、53.1) |
| (IU/dL) | Day7 (168時間) | Day10 (240時間) | Day14 (336時間) |
|---|---|---|---|
| N 平均値(SD) 中央値 (範囲) | 44 13.8(4.73) 13.5 (4.9、24.5) | 38 9.59(4.14) 10.2 (3.4、24.8) | 35 6.10(3.29) 5.30 (1.9、19.7) |
【対象及び方法】
日本人10例を含む血友病B[血液凝固第IX因子(FIX)活性≦2%]患者45例を対象に、イデルビオン50 IU/kgを単回静脈内投与した際のFIX活性を評価した。また、一部の患者では、イデルビオン投与前に使用していたFIX製剤(pdFIX又はrFIX)によるFIX活性を評価した。FIX活性はシリカを含むaPTT試薬を用いた凝固一段法による中央測定により算出し、標準に対する%[100%=1 IU/mL(100 IU/dL)]とした。
(5)母集団PK解析を用いたFIX活性シミュレーション5)
母集団PKモデルを用いて50 IU/kg単回投与によるFIX活性のシミュレーションを行ったところ、トラフ値は下記のとおりであった。
●血漿中のFIX活性トラフ値(%)の中央値[90%推測区間]
| 用法・用量 | 0~6歳未満 | 6~12歳未満 | 12~18歳未満 | 12歳以上 | 18歳以上 |
|---|---|---|---|---|---|
| 50 IU/kg 7日間隔 | 8.6[4.4、15.9] | 12.6[6.3、23.1] | 17.4[9.0、30.3] | 20.0[10.3、35.5] | 20.3[10.5、36.0] |
| 75 IU/kg 14日間隔 | 3.7[1.6、7.9] | 5.7[2.4、12.3] | 8.2[3.6、16.3] | 9.7[4.4、19.5] | 9.9[4.5、19.8] |
| 100 IU/kg 21日間隔 | 2.2[1.0、5.0] | 3.3[1.4、7.9] | 4.9[2.1、11.1] | 5.9[2.5、13.3] | 6.1[2.5、13.5] |
また、FIX活性中央値が1%以上を維持する(基準値の1%に達する)期間は、12歳以上で約25日、6~12歳未満の小児で約19日、0~6歳未満の小児で約15.5日と予測された。
イデルビオン50 IU/kg単回投与後のFIX活性持続時間
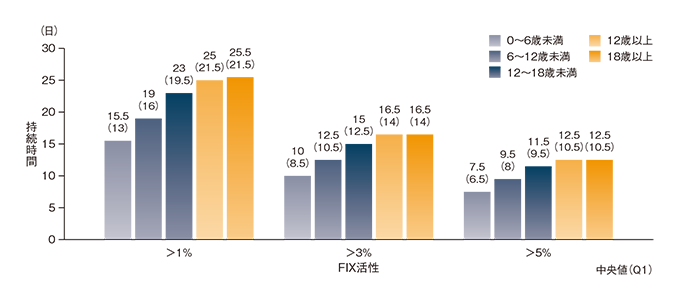
【対象及び方法】
イデルビオンの承認時臨床試験(5試験)から得られたPK統合データについて、1~63歳の患者計113例から得られた3,387測定点でのFIX活性データを使用し、母集団PK解析を行った。FIX活性は、体重及び体重で補正した投与量を共変量とした2-コンパートメントモデルとした。FIX活性はシリカを含むaPTT試薬を用いた凝固一段法による中央測定により算出し、標準に対する%[100%=1 IU/mL(100 IU/dL)]とした。
- Santagostino E et al.: Blood. 2016; 127(14): 1761-1769
本研究はCSLベーリングの支援により行われ、本論文著者のうち4名はCSLベーリングから講演料、コンサルタント料などを受け取っており、本論文著者のうち3名はCSLベーリングの社員である。 - 社内資料:日本人を含む国際多施設共同非盲検第Ⅲb相継続試験(3003試験)(承認時評価資料)
- Mancuso ME et al.: J Thromb Haemost. 2020; 18(5): 1065-1074
本研究はCSLベーリングの支援により行われ、本論文著者のうち3名はCSLベーリングから講演料、コンサルタント料などを受け取っており、本論文著者のうち2名はCSLベーリングの社員である。 - 社内資料:日本人を含む国際多施設共同非盲検第Ⅱ/Ⅲ相試験(3001試験)(承認時評価資料)
- 社内資料:母集団PK解析(承認時評価資料)
JPN-AFS-1834
2024年6月改訂
薬効薬理 非臨床試験
(1)各種動物の血漿における凝固パラメータ(aPTT)に対する作用(in vitro)1)
アルブトレペノナコグ アルファ0.5、1.0、1.5及び2.0 IU/mLをヒト、サル、ラット及びウサギの血漿に添加し、活性化部分トロンボプラスチン時間(aPTT)に対する作用を検討したところ、用量依存的なaPTTの短縮が示された。aPTTの短縮はサル血漿で−26%、ラットで−15%、ヒトで−9%、ウサギで−8%であった。
(2)凝固パラメータ(aPTT)及び全血凝固時間(WBCT)に対する作用(血友病Bイヌ)2)
aPTT及びWBCTはいずれも投与後に低下した。aPTTがベースライン値の60%未満であった期間は、アルブトレペノナコグ アルファ群が5.4日、ノナコグアルファ群が1.6日であった。一方、WBCT値はいずれの投与群においても約7日間にわたり約10分であった。
アルブトレペノナコグ アルファ又はノナコグアルファ100 IU/kg単回静脈内投与後の平均aPTT値及び平滑化スプライン曲線
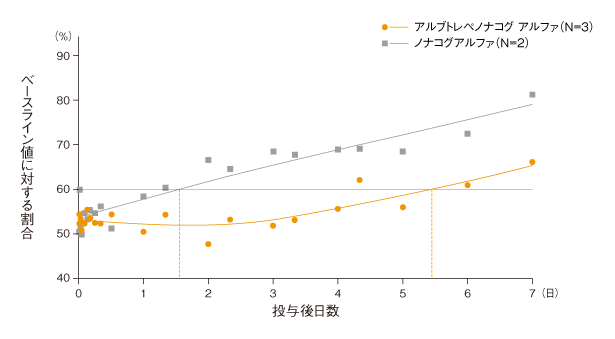
【実験方法】
血友病Bイヌにアルブトレペノナコグ アルファ(N=3)又はノナコグアルファ(N=2)をそれぞれ100 IU/kg単回静脈内(ボーラス)投与し、血液試料を36日目まで採取し、凝固パラメータ(aPTT)及び全血凝固時間(WBCT)に対する作用を検討した。
(3)止血作用(FIX欠損マウス)3)
アルブトレペノナコグ アルファの単回静脈内投与により、いずれの投与量でも対照群と比較して明らかな止血作用が認められ、有意な止血時間の短縮及び総失血量の減少が認められた(P<0.05:log-rank検定)。
アルブトレペノナコグ アルファ又はノナコグアルファ単回静脈内投与後の止血時間に対する作用
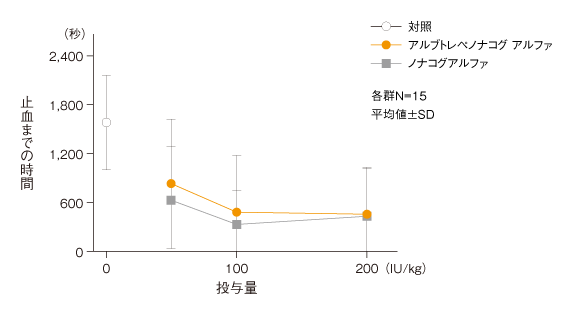
【実験方法】
血友病Bマウス(FIX欠損マウス)にアルブトレペノナコグ アルファ又はノナコグアルファをそれぞれ50、100及び200 IU/kg(各群N=15)を単回静脈内(ボーラス)投与し、投与15分後に尾端を約3mm切除する尾端出血試験を行い、総失血量及び止血時間を計測した。なお、対照群には生理食塩液を投与した。
(4)凝固パラメータ(aPTT)に対する作用(FIX欠損マウス)4)
アルブトレペノナコグ アルファの単回静脈内投与によるaPTTの短縮は、以下のとおりであった。
アルブトレペノナコグ アルファ又はノナコグアルファ単回静脈内投与後のaPTT値に対する作用
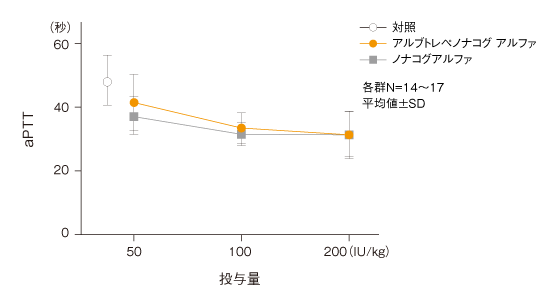
【実験方法】
血友病Bマウス(FIX欠損マウス)にアルブトレペノナコグ アルファ又はノナコグアルファをそれぞれ50、100及び200 IU/kg(各群N=14~17)を単回静脈内(ボーラス)投与し、凝固パラメータ(aPTT)を測定した。なお、対照群には生理食塩液を投与した。
- 社内資料:in vitro薬効薬理試験(承認時評価資料)
- 社内資料:イヌの単回静脈内投与による薬力学的試験(承認時評価資料)
- 社内資料:第IX因子ノックアウトマウスモデルにおける止血効果(承認時評価資料)
- 社内資料:第IX因子ノックアウトマウスモデルにおけるaPTTに対する効果(承認時評価資料)
JPN-AFS-1834
2024年6月改訂
調製方法安全性薬理試験および毒性試験
1.調製方法
※作業はすべて無菌的に行ってください。
(1)溶解準備
- イデルビオンを冷蔵庫から取り出した場合は、室温に戻しておく。25℃を超えて保存した場合は使用しない。
- 作業場所(水平な台)を清潔にし、手を石けんでしっかり洗う。
- 使用前にバイアルに異常(変色、濁り、容器の破損など)がないか確認する。
- 薬剤バイアルと溶解液バイアルのキャップを外し、ゴム栓をアルコール綿で拭く。
(2)バイアルのセット
- 専用溶解器(スリートック通気孔タイプ)の包装容器のふたをはがす。
- 溶解器を包装容器ごと持ち、青色側の穿刺部を溶解液バイアルのゴム栓にまっすぐ下向きに刺し込む(図1)。
- 包装容器を溶解器から慎重に外す(図2)。
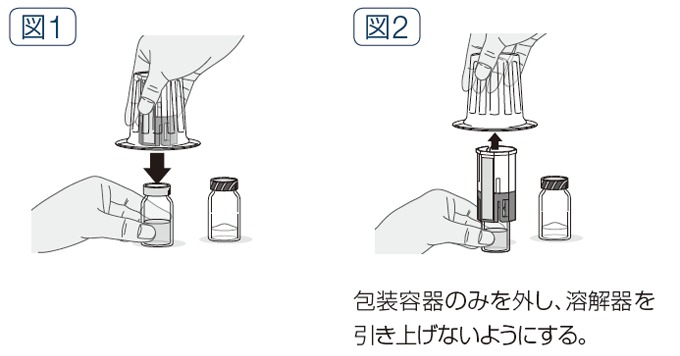
(3)薬剤の溶解
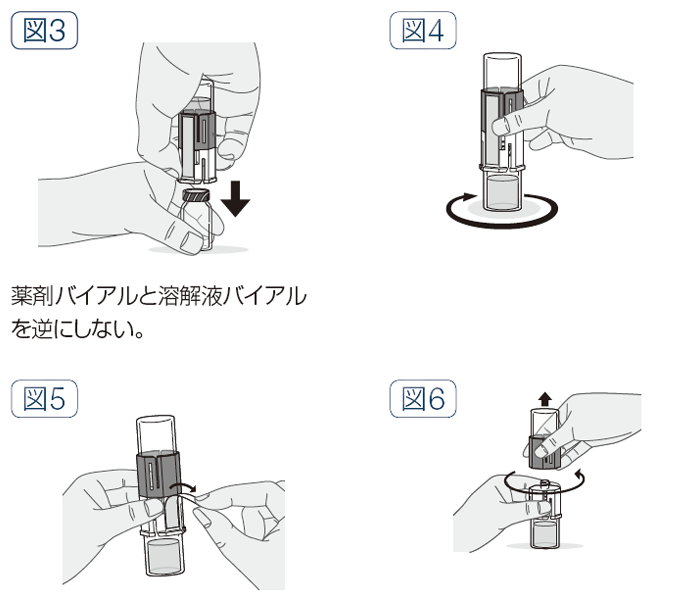
- 溶解液バイアルを逆さまにし、透明側の穿刺部を下に置いた薬剤バイアルのゴム栓に、まっすぐ下向きに一気に刺し込み、溶解液を薬剤バイアル中に移行させる(図3)。
- そのまま台の上で、薬剤バイアルをゆるやかに、小さく円を描くように回し(激しく回さない)、完全に薬剤を溶かす(図4)。
- 溶解器側面のシールをはがす(図5)。
- 溶解器の青色側の部分を反時計回りに回して2つに分ける(図6)。
(4)薬液を注射器に移す
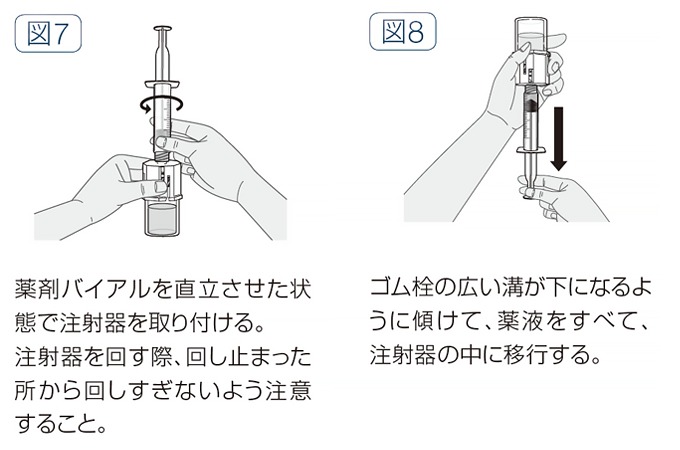
- 空の滅菌済注射器に空気が入っていないことを確認し、溶解器のルアーロックの奥まで注射器を時計回りに回しながら取り付ける(図7)。
- 薬剤バイアルを上にして、プランジャーロッドをゆっくりと引き、薬液を注射器の中に移行する(図8)。
- すべての薬液を注射器の中に移行したら、注射器を下にしたまま、溶解器を反時計回りに回して注射器から外す。
(5)注射器に翼状針を取り付ける
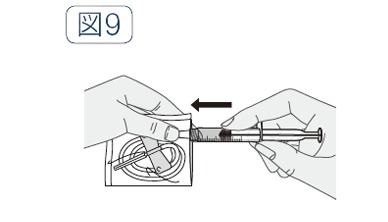
- 翼状針の接続部分が袋の切り口近くにくるように、翼状針の袋を開ける。
- 薬液を移行した注射器を、翼状針の接続部分に差し込み、取り付ける(図9)。
- 袋を外し、注射器のプランジャーロッドを少し押して、薬液を針先まで満たす。
2.安全性薬理試験(ラット、サル)1-6)
| 試験項目 | 動物種/ 系統 | 性別/ 匹数 | 投与期間/ 経路 | 投与量 (IU/kg) | 試験結果 | |
|---|---|---|---|---|---|---|
| 呼吸器系への影響 | 呼吸系パラメータ (呼吸数、1回換気量、 分時換気量) | ラット/SD | 雄8 | 単回/ 静脈内 | 0、75、150、500 | 影響なし 無毒性量: ≧500 IU/kg |
| 心血管系への影響 | 心電図、血圧、 心拍数 | サル/ カニクイザル | 雄4、雌4 | 4週間反復(連日)/ 静脈内 | 0、75、150、500 | 影響なし |
| 中枢神経系 への影響 | 一般状態観察、 剖検、 病理組織学的検査 (一般毒性試験) | ラット/SD | 雄5、雌5 | 単回/ 静脈内 | 0、75、150、500 | 影響なし |
| サル/ カニクイザル | 雄3、雌3 | 単回/ 静脈内 | 0、75、150、500 | 影響なし | ||
| ラット/SD | 雄15、雌15 | 4週間反復(連日)/ 静脈内 | 0、75、150、500 | 影響なし | ||
| ラット/SD | 500 IU/kg: 雄13、雌13 2,000 IU/kg: 雄22、雌23 | 26週間反復(連日)/ 静脈内 | 0、500、2,000 | 影響なし | ||
| サル/ カニクイザル | 雄4、雌4 | 4週間反復(連日)/ 静脈内 | 0、75、150、500 | 影響なし | ||
3.毒性試験
(1)単回投与毒性試験(ラット、サル)3、4)
| 動物種/ 系統 | 性別/ 匹数 | 投与経路 | 投与量 (IU/kg) | 無毒性量/ 概略致死量 | 試験結果 |
|---|---|---|---|---|---|
| ラット/SD | 雄5、雌5 | 静脈内 | 0、75、150、500 | 500 IU/kg/ >500 IU/kg | 500 IU/kgの雌でプロトロンビン時間延長 500 IU/kgの雌雄及び150 IU/kg以上の雌で 血漿カリウム値高値 |
| サル/ カニクイザル | 雄3、雌3 | 静脈内 | 0、75、150、500 | 500 IU/kg/ >500 IU/kg | 150 IU/kg以上の雌で軽度の血漿ビリルビン高値 |
(2)反復投与毒性試験(ラット、サル)2、5、6)
| 動物種/ 系統 | 性別/匹数 | 投与期間/ 投与経路a | 投与量 (IU/kg) | 無毒性量 | 試験結果 |
|---|---|---|---|---|---|
| ラット/SD | 雄15 雌15 | 4週間(連日)/静脈内 | 0、75、150、500 | 500 IU/kg | 4週間投与の終了後、ヒトアルブミン又は ヒトFIXに対する抗体産生を示す免疫反応が認められ、 初期反応は16日目に3匹であった。 |
| ラット/SD | 500 IU/kg: 雄13、雌13 2,000 IU/kg: 雄22、雌23 | 26週間(連日)b/静脈内 | 0、500、2,000 | 200 IU/kg | 毒性所見なし |
| サル/ カニクイザル | 雄4、雌4 | 4週間(連日)/静脈内 | 0、75、150、500 | 500 IU/kg | 多くの動物で抗ヒトFIX抗体産生が、 1匹にヒトアルブミン抗体産生が認められた。 |
b:第1相と第2相に分けて実施(第1相で毒性評価を妨げる抗体産生がない場合に第2相を実施し、両方合わせて評価した)。
注:対照群には生理食塩液を投与した。
(3)遺伝毒性試験7、8)
| 試験項目 | 動物種(株) | 投与量 | 試験結果 |
|---|---|---|---|
| 細菌を用いる復帰突然変異試験 (Ames試験) | ネズミチフス菌 (TA1535、TA1537、TA98、TA100株) 大腸菌(WP2uvrA株) | 0、0.1~200 IU/プレート | 陰性 |
| 哺乳類細胞(ヒトリンパ球)を用いる in vitro染色体異常試験 | ヒトリンパ球 (ラット肝由来S9mixの存在下/非存在下) | 0、7.2、12、20 IU/mL | 陰性 |
(4)局所刺激性試験9)
| 動物種/系統/性別/匹数 | 投与量(投与方法) | 試験結果 |
|---|---|---|
| ウサギ/NZW/雌4 | 1.2mL/匹(静脈内) 1.3mL/匹(動脈内) 0.2mL/匹(静脈周囲) | 投与局所の所見及び全身症状なし |
(5)血栓形成性試験10)
| 動物種/系統/性別/匹数 | 投与量(投与方法) | 試験結果 |
|---|---|---|
| ウサギ/NZW/雄3、雌3 | 0、75、150、500 IU/kg (単回静脈内) | 血栓形成性なし |
- 社内資料:覚醒ラットにおける呼吸系パラメータの評価(承認時評価資料)
- 社内資料:カニクイザルにおける4週間静脈内投与毒性試験(承認時評価資料)
- 社内資料:ラットにおける単回投与毒性試験(承認時評価資料)
- 社内資料:カニクイザルにおける単回投与毒性試験(承認時評価資料)
- 社内資料:ラットにおける4週間静脈内投与毒性試験(承認時評価資料)
- 社内資料:ラットにおける26週間静脈内投与毒性試験(承認時評価資料)
- 社内資料:細菌を用いる復帰突然変異試験(承認時評価資料)
- 社内資料:ヒトリンパ球を用いるin vitro染色体異常試験(承認時評価資料)
- 社内資料:ウサギにおける局所刺激性試験(承認時評価資料)
- 社内資料:ウサギにおける血栓形成性試験(承認時評価資料)
JPN-AFS-1834
2024年6月改訂
製剤学的事項
1.製剤の安定性
イデルビオンを各条件下で保存後、性状、温度、光安定性、比活性、SE-HPLC、について試験を実施した結果を下表に示す。
イデルビオン静注用の各種条件下における安定性
| 試験 | 保存条件 | 実施期間 | 試験結果 |
|---|---|---|---|
| 長期保存試験 | 5±3℃、 60±5%RH1) | 36ヵ月 | 変化なし |
| 25±2℃、 60±5%RH | |||
| 加速試験 | 40±2℃、 75±5%RH | 6ヵ月 | FIX活性の低下、目的物質の減少 及び目的物質由来不純物の増加が認められた。 |
| 苛酷試験 (温度)2) | 50±2℃ | 4週間 | |
| 苛酷試験 (光)3) | 25℃/60%RH/総照度: 120万lux・h以上、 総近紫外放射エネルギー: 200W・hr/m2以上 | 1週間 | |
| 溶解後安定性試験1) | 20~25℃ | 溶解後 8時間 | 変化なし |
2)イデルビオン静注用 500のみで実施
3)イデルビオン静注用 250のみで実施
2.製造工程
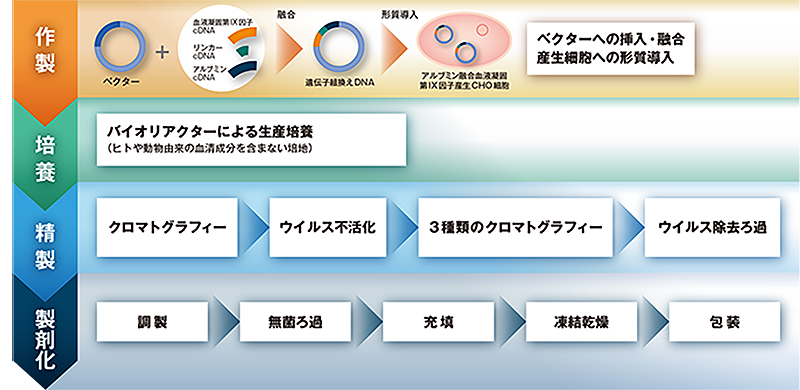
CHO:チャイニーズハムスター卵巣
JPN-AFS-1834
2024年6月改訂
取扱い上の注意
| 規制区分 | 生物由来製品、処方箋医薬品(注意-医師等の処方箋により使用すること) |
|---|---|
| 貯法 | 2~25℃で保存 |
| 有効期間 | 36箇月 |
| 取扱い上の注意 | 外箱開封後は遮光して保存すること。 |
JPN-AFS-1834
2024年6月改訂
災害時におけるイデルビオンの保存に関する注意
室温が2℃未満になる、または25℃を超える恐れがあるためイデルビオンを冷蔵庫で保存していた場合、停電から復旧後はイデルビオンを使わないでください。
室温(2~25℃)で保存していた場合は、そのままお使いください。
イデルビオン静注用の各種条件下における安定性
| 試験 | 保存条件 | 実施期間 | 試験結果 |
|---|---|---|---|
| 長期保存試験 | 5±3℃、 60±5%RH1) | 36ヵ月 | 変化なし |
| 25±2℃、 60±5%RH | |||
| 加速試験 | 40±2℃、 75±5%RH | 6ヵ月 | FIX活性の低下、目的物質の減少 及び目的物質由来不純物の増加が認められた。 |
| 苛酷試験 (温度)2) | 50±2℃ | 4週間 | |
| 苛酷試験 (光)3) | 25℃/60%RH/総照度: 120万lux・h以上、 総近紫外放射エネルギー: 200W・hr/m2以上 | 1週間 | |
| 溶解後安定性試験1) | 20~25℃ | 溶解後 8時間 | 変化なし |
- イデルビオン静注用 250、500、1000、2000で実施
- イデルビオン静注用 500のみで実施
- イデルビオン静注用 250のみで実施
2024年6月改訂