臨床成績 日本人を含む国際多施設共同非盲検第Ⅲb相継続試験(3003試験、海外データ)1、2)
イデルビオン第Ⅲb相試験(3003試験)は海外で実施された試験であるとともに承認時評価資料です。
本試験では承認外の用法である10日間隔定期補充群が含まれております。本資材では原著との整合性並びに適正使用確保を目的として10日間隔定期補充群の記載を含めております。
承認を受けた用法・用量については電子添文もしくは以下の記載内容をご確認ください。
1. 試験概要
試験デザイン
国際、多施設共同(15ヵ国、39施設)、プロスペクティブ、非盲検、第Ⅲb相継続試験
目的
血友病B患者を対象に、出血抑制(定期補充療法)におけるイデルビオンの有効性及びFIXインヒビターの発現を含む安全性を評価する。(外科的サブスタディでの術中の出血予防と管理を含む)
対象
FIXインヒビター発現の既往が確認されていない重症(FIX活性≦2%)血友病B患者 83例(日本人9例を含む);
第1群:3001試験の定期補充療法群及び3002試験又はその他のリードイン試験を完了した患者 60例
第2群:3001試験のオンデマンド療法群を完了した患者 16例
第3群: イデルビオンのリードイン試験に参加していない緊急性のない大手術を予定している患者 7例(外科的サブスタディは、2015年7月28日カットオフ時点で第1、2群を含めて13例)
方法
定期的な投与の用法・用量は、開始から6ヵ月間が経過した後に、治験責任医師の判断で変更可能とした。
イデルビオン100 IU/kgの単回投与による薬物動態評価を受けた患者(18歳以上)において、6ヵ月間以上安定した用量で14日に1回投与が行われた場合にイデルビオン100 IU/kgの21日に1回投与へ変更できることとした。
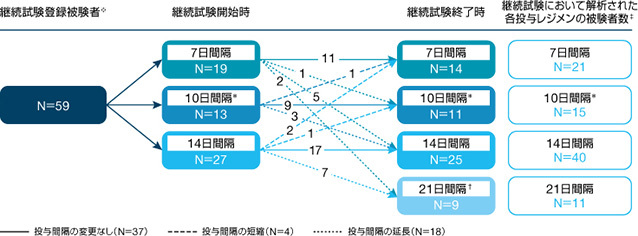
※:外科的サブスタディに参加した7例の新規被験者が継続試験に直接登録された。
†:14日間隔投与で少なくとも6ヵ月間良好に管理されていた18歳以上の被験者のみが21日間隔投与に変更可能であった。
‡:各投与レジメンの被験者数は、試験期間中に少なくとも12週間、当該の投与レジメンによる治療を受けた被験者の総数を示す。
被験者は試験期間中に複数の投与レジメンに割り付けられ、6ヵ月間の追跡調査中、又は治験責任医師の裁量で投与間隔を変更することができた。
*:本邦未承認
Mancuso ME et al.: J Thromb Haemost. 2020; 18(5): 1065-1074 ©John Wiley and Sons
本研究はCSLベーリングの支援により行われ、本論文著者のうち3名はCSLベーリングから講演料、コンサルタント料などを受け取っており、本論文著者のうち2名はCSLベーリングの社員である。
主要評価項目
安全性
ナイメゲン変法を用いたベセスダ測定に基づくインヒビターの発現(0.6BU/mL以上)の有無
副次評価項目
| 有効性 | 年間出血回数(AsBR)及び出血を生じた患者数(ABR) |
|---|---|
| 安全性 | 有害事象及び副作用(本剤に関連する有害事象)の発現頻度 |
探索的評価項目
患者当たりの年間の総投与日数、本剤又はチャイニーズハムスター卵巣(CHO)宿主細胞由来タンパク質に対する抗体の発現
その他の評価項目
薬物動態(PK)
単回投与時における0時間から最終定量可能時間までの血中濃度-時間曲線下面積(AUC0-t)、血中半減期(t1/2)、投与30分後の回収率(IR)、クリアランス(CL)など
外科的サブスタディ
有効性(2015年7月28日カットオフ時点まで)
4点順序尺度(著効、有効、やや有効、無効/反応なし)に基づいた治験責任医師による周術期止血効果の総合的臨床評価
有効性/安全性解析集団
本試験には83例[12歳以上59例(うち日本人被験者9例)]が組み入れられ、全例を有効性解析集団及び安全性解析集団とした。
解析計画
ABR(回/人・年)は(評価期間中の出血回数/評価期間の総日数)×365.25(AsBRは自然出血回数をABRと同様に年換算したもの)として算出した。
主要評価項目
インヒビター産生を全体について要約し、インヒビター産生の発生割合の両側95%信頼区間(CI)を算出した。インヒビターを有する患者がいない場合は、片側97.5%CI上限値を算出した。
副次評価項目
| 有効性 | 定期補充療法期間中のAsBR及びABRを、全体及び投与群別に要約し、自然出血エピソードの年間回数も、主要有効性解析集団を対象に解析した。解析結果は、各治療期間のポアソン分布に基づき、95%CIと共に示した。 |
|---|---|
| 安全性 | 試験治療下で発現した有害事象が1件以上発現した患者数、及び割合並びに事象の件数を、器官別大分類(SOC)別及び基本語(PT)別に要約した。有害事象は件数をSOC・PT別に要約、臨床検査値(凝固因子活性検査値を含む)、本剤又はCHO宿主細胞由来タンパク質の抗体の検査結果、及びバイタルサイン測定結果を要約した。 |
その他の評価項目
PK解析集団を対象に、記述統計量及び幾何平均を、薬剤用量別及び規定の時点別に提示した。記述統計量は、投与群別、年齢別、日本人と非日本人別で層別化した。
外科的サブスタディ
手術に関するデータを症例の叙述として、記述統計もしくは総数で要約した。周術期の止血効果に対する治験責任医師による総合的な臨床評価を4点順序尺度に基づいて示した。
2. 定期補充療法に対する有効性
1)定期補充療法における出血の種類別年間出血回数(副次評価項目)
21日間隔の定期補充療法における年間出血回数(ABR)の中央値[第1四分位値(Q1)、第3四分位 値(Q3)]は、総出血(総ABR)、自然出血(AsBR)及び関節内出血でそれぞれ0.32(0.00、2.48)、0.00(0.00、0.45)及び0.00(0.00、1.78)であった。
出血の種類別年間出血回数(12歳以上)
| 定期補充療法の投与間隔 | |||
|---|---|---|---|
| 年間出血回数 (件/年/例) | 7日間隔(N=22) | 14日間隔(N=41) | 21日間隔(N=11) |
| 総出血(総ABR) 平均値(SD) 中央値(Q1、Q3) | 2.50(2.60) 1.33(0.36、4.17) | 2.33(3.36) 0.92(0.00、2.94) | 1.19(1.57) 0.32(0.00、2.48) |
| 自然出血(AsBR) 平均値(SD) 中央値(Q1、Q3) | 1.30(1.96) 0.00(0.00、1.67) | 1.24(2.26) 0.37(0.00、1.68) | 0.60(1.41) 0.00(0.00、0.45) |
| 関節内出血 平均値(SD) 中央値(Q1、Q3) | 1.79(2.43) 0.80(0.00、2.34) | 1.63(3.17) 0.13(0.00、2.34) | 0.93(1.56) 0.00(0.00、1.78) |
Mancuso ME et al.: J Thromb Haemost.2020; 18(5): 1065-1074 ©John Wiley and Sonsより改変
本研究はCSLベーリングの支援により行われ、本論文著者のうち3名はCSLベーリングから講演料、コンサルタント料などを受け取っており、本論文著者のうち2名はCSLベーリングの社員である。
2)100 IU/kg投与群の年間自然出血回数(副次評価項目)
イデルビオン100 IU/kgの21日に1回投与を受けた18歳以上の患者11例のAsBRの中央値(範囲)は0.00(0.0、4.7)であった。
定期補充療法における年間自然出血回数:7日間隔及び14日間隔投与と21日間隔投与の比較(18歳以上)
| 定期補充療法の投与間隔 | |||
|---|---|---|---|
| AsBR | 7日間隔(N=11) | 14日間隔(N=11) | 21日間隔(N=11) |
| 平均値(SD) | 0.14 (0.477) | 0.23 (0.596) | 0.60 (1.408) |
| 中央値(範囲) | 0.00 (0.0、1.6) | 0.00 (0.0、2.0) | 0.00 (0.0、4.7) |
(3)周術期止血管理に対する臨床評価(主要評価項目)
データカットオフ時点で、外科的サブスタディに参加した13例13件における周術期の出血抑制効果は、創閉鎖時(0時間)及び72時間後/退院時点において「著効」又は「有効」と評価された。
28日間の手術期間中に望ましいFIXレベルが得られ、イデルビオンの投与回数は術前単回投与を含めて計2~13回であった。日本人患者は1例が参加し、手術後2時点[創閉鎖時(術後0時間)及び退院時]で治験責任医師が「著効」と評価した。
周術期の出血抑制効果
| 手術 | 止血効果の評価 | ||
|---|---|---|---|
| 創閉鎖 (0時間) | 72時間又は退院a | 手術期間中の 本剤投与回数b | |
| 色素性母斑切除、腰部 | 報告なし | 著効 | 3 |
| 鼻形成及び下鼻甲介骨切除術 による粘膜下切除 | 著効 | 著効 | 4 |
| 右足関節形成 | 著効 | 著効 | 6 |
| 内視鏡的粘膜切除術 | 著効 | 著効 | 4 |
| 人工膝関節全置換、左 | 有効 | 報告なし | 6 |
| 人工膝関節全置換、右 | 著効 | 著効 | 7 |
| 根管 | 報告なしc | 報告なしc | 3 |
| 右膝関節プロテーゼ置換 | 報告なしc | 著効 | 11 |
| 包茎環状切除 | 著効 | 著効d | 3 |
| 人工膝関節全エンドプロテーゼ | 報告なしc | 著効d | 13 |
| 環状切除 | 著効 | 著効 | 2 |
| 人工膝関節全置換、右 | 著効 | 著効 | 13 |
| 人工膝関節全置換、左 | 著効 | 有効 | 12 |
b:術前投与及び術後投与を含むすべての投与を術後14日間(336時間)カウントした。
c:止血効果の総合的な評価(著効)のみが報告された。
d:術後24時間の時点での評価
注:2015年7月28日のデータカットオフ時点のデータ
[評価基準]
| 著効 | 臨床的止血が正常(非血友病患者の同様の手術で予想される止血達成)と明らかに違わない、又は、術中失血量が予想される失血量の120%を超えない。 |
|---|---|
| 有効 | 量的及び/又は質的に、正常~軽度の止血の異常(軽度のoozing、非血友病患者との比較における失血量の増加と止血までの時間の延長)を示す、又は、術中失血量が予想される失血量の120%より多く130%以下である。 |
| やや有効 | 量的及び/又は質的に、中等度の止血の異常(制御が困難な中等度の出血)を示し、術中失血量が「有効」で規定した基準より多い。 |
| 無効/反応なし | 量的及び/又は質的に、重度の止血の異常(制御が困難な重度の出血)を示し、かつ/又は、完全な止血のためには他のFIX製剤又は血漿製剤の投与による追加の止血処理を必要とする。 |
4. 安全性
1)インヒビター及び抗体(主要/探索的評価項目)
安全性解析集団においてインヒビターの発現の報告はなかった。イデルビオン又はチャイニーズハムスター卵巣(CHO)宿主細胞由来タンパク質に対する抗体の発現が報告された症例はなかった。日本人症例においても、インヒビターの発現は認められなかった。
2)有害事象及び副作用(副次評価項目)
12歳以上の安全性解析集団59例中51例(86.4%)に330件の有害事象が認められた。59例中2例(3.4%)2件[浮動性めまい、末梢性虚血(各1件)]に副作用(本剤に関連する有害事象)が認められ、末梢性虚血は、治験責任医師によりイデルビオン投与との因果関係ありとされたが、以前受けた膝関節置換術に起因している可能性が示唆されたことから治験依頼者により因果関係は否定された。これらの副作用の重症度は、末梢性虚血は重度かつ重篤、浮動性めまいは軽度であった。重篤な有害事象は、10例(16.9%)に19件(鉄欠乏性貧血2件、扁桃周囲膿瘍、関節腫脹、末梢性虚血、関節炎、血清フェリチン減少、痔核、食道炎、挫傷、血腫、交通事故、処置後出血、出血性関節症、大腸ポリープ、血友病性関節症、貧血、大腿骨骨折、頭蓋内出血各1件)認められたが、末梢性虚血を除き、いずれもイデルビオン投与との因果関係はないと判断された。死亡に至った頭蓋内出血の1例は、50 IU/kgの10日に1回投与を実施しており、当該事象はオートバイ事故によるもので、イデルビオン投与との因果関係は否定された。投与中止に至った症例はなかった。日本人安全性解析集団9例中8例(88.9%)に86件の有害事象が認められたが、イデルビオン投与との因果関係はないと判断された。重篤な有害事象は、1例に4件(大腸ポリープ、血友病性関節症、貧血、大腿骨骨折各1件)認められ、転帰は血友病性関節症が軽快、その他は回復であり、いずれもイデルビオン投与との因果関係はないと判断された。投与中止に至った症例、死亡例はなかった。
- 社内資料:日本人を含む国際多施設共同非盲検第Ⅲb相継続試験(3003試験)(承認時評価資料)
- Mancuso ME et al.: J Thromb Haemost. 2020; 18(5): 1065-1074
本研究はCSLベーリングの支援により行われ、本論文著者のうち3名はCSLベーリングから講演料、コンサルタント料などを受け取っており、本論文著者のうち2名はCSLベーリングの社員である。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、緩徐に静脈内に注射する。
通常、1回体重1kg当たり50国際単位を投与するが、患者の状態に応じて適宜増減する。
定期的に投与する場合、通常、体重1kg当たり35~50国際単位を7日に1回投与する。また、患者の状態に応じて、体重1kg当たり75国際単位の14日に1回投与に変更することもできる。さらに、14日に1回投与し、6ヵ月以上状態が安定している12歳以上の患者では、体重1kg当たり100国際単位の21日に1回投与に変更することもできる。なお、いずれの投与間隔においても投与量は適宜調節するが、7日又は14日に1回投与の場合は1回体重1kg当たり75国際単位を、21日に1回投与の場合は1回体重1kg当たり100国際単位を超えないこと。
2024年6月改訂