臨床成績 小児血友病B患者を対象とした国際多施設共同非盲検第Ⅲ相試験(3002試験、海外データ)1、2)
1. 試験概要
試験デザイン
国際、多施設共同(10ヵ国18施設)、プロスペクティブ、非盲検、第Ⅲ相試験
目的
重症の小児血友病B患者を対象に、イデルビオン単回投与後の薬物動態(PK)、及び安全性としてFIXインヒビターの発現を評価する。
対象
12歳未満の重症(FIX活性≦2%)血友病B患者 27例(6歳未満 12例、6歳以上12歳未満 15例)、うち外科的サブスタディ 2例
- FIXインヒビター発現の既往が確認されていない患者
- FIX補充療法を現在受けており、FIX製剤の投与日数が150ED以上(6歳以上12歳未満)又は50ED以上(6歳未満)の患者
方法
スクリーニング期間1ヵ月未満、PK評価期間最長14日、治療期間約11ヵ月とした。
治療期間は全例が7日間隔の定期補充療法及び出血エピソードに対するオンデマンド療法を行った。投与量は35~50 IU/kg(最大75 IU/kgまで増量可)とし、FIX活性のトラフ値を3~5%に維持できるよう調整した。
外科的サブスタディとして、試験期間中に、緊急性のない外科手術が必要となった場合、手術時の補充療法として本剤を使用できることとした。

主要評価項目
薬物動態(PK)
イデルビオン50 IU/kg単回投与後のPK
※FIX活性はシリカを含むaPTT試薬を用いた凝固一段法による中央測定により算出し、標準に対する%[100%=1 IU/mL(100 IU/dL)]とした。
安全性
ナイメゲン変法を用いたベセスダ測定に基づくインヒビターの発現(0.6BU/mL以上)
副次評価項目
有効性
- イデルビオンの投与量[投与回数並びに月間、年間及び1出血エピソード当たりの投与量(IU/kg)]
- 止血が得られるまでの投与回数
安全性
副作用(本剤に関連する有害事象)の発現頻度、抗体の発現
その他の評価項目
- 4点順序尺度(著効、有効、やや有効、無効/反応なし)に基づいた治験責任医師による止血効果の総合的臨床評価(出血、周術期止血管理)
- 定期補充療法期間中の年間出血回数(ABR) など
有効性解析集団
本試験の有効性評価に含まれ、イデルビオンの投与を1回以上受けた全ての患者 27例
安全性解析集団
試験期間中にイデルビオンの投与を少なくとも1回受けた全ての患者 27例
※有効性及び安全性について、全体及び年齢層別(6歳未満、6歳以上12歳未満)で評価した。
解析計画
定期補充療法期間中の本剤の投与量について、記述統計量を用いて年齢層別に要約した。
止血を得るために本剤を1回、2回又は2回超投与した出血エピソードの割合を、全ての出血を対象に、出血の重症度、部位及び種類別に、並びに全体を年齢層別に集計した。1回又は2回の本剤の投与で止血が得られた場合は、治療は成功とみなした。出血治療の成功率の95%信頼区間(CI)を示した。
定期補充療法期間中のABRを、自然、関節及び総出血について、全体及び年齢層別に要約した。治験責任医師による出血に対する止血効果の総合的な臨床評価について、出血の重症度(軽度/中等度出血及び重大な出血)別に、全体及び年齢層別に集計した。
周術期止血管理を目的とした本剤の止血効果の総合的な臨床評価として、治験責任医師による4点順序尺度を用いて評価集計した。
ED:投与日(Exposure day)、ABR:年間出血回数(Annualized bleeding rate)
2. 定期補充療法に対する有効性
1)定期補充療法における出血の種類別年間出血回数(その他の評価項目)
有効性解析集団(27例)において、定期補充療法期間中の年間出血回数(ABR)の中央値[第1四分位値(Q1)、第3四分位値(Q3)]は、総出血(総ABR)及び自然出血(AsBR)でそれぞれ3.12(0.91、5.91)及び0.00(0.00、0.91)であった。各年齢層別の総ABR及びAsBRは以下の通りであった。
出血の種類別年間出血回数
| 年間出血回数 (件/年/例) | 6歳未満(N=12) | 6歳以上12歳未満(N=15) | 全体(N=27) |
|---|---|---|---|
| 総出血(総ABR) 発現例数(%)* 平均値(SD) 中央値(Q1、Q3) | 11(91.7) 4.22(3.56) 2.64(2.00、6.48) | 12(80.0) 3.44(3.18) 3.39(0.76、5.91) | 23(85.2) 3.78(3.31) 3.12(0.91、5.91) |
| 自然出血(AsBR) 発現例数(%)* 平均値(SD) 中央値(Q1、Q3) | 1(8.3) 0.08(0.29) 0.00(0.00、0.00) | 9(60.0) 0.96(1.10) 0.78(0.00、1.99) | 10(37.0) 0.57(0.94) 0.00(0.00、0.91) |
| 関節内出血 発現例数(%)* 平均値(SD) 中央値(Q1、Q3) | 6(50.0) 1.20(1.99) 0.50(0.00、1.45) | 10(66.7) 1.60(1.72) 1.13(0.00、2.36) | 16(59.3) 1.42(1.82) 0.99(0.00、2.33) |
2)定期補充療法期間中のイデルビオン投与量(副次評価項目)
定期補充療法の平均投与回数は4.3回/月であった。本試験参加前の1週当たりの平均投与量(SD)は107.1(93.3)IU/kgであったのに対し、本剤週1回の平均投与量[標準偏差(SD)]は47.2(9.5)IU/kgであった。なお、イデルビオンの平均投与量は、6歳未満では49.1(10.2)IU/kg、6歳以上12歳未満では45.6(8.9)IU/kgであった。
定期補充療法期間中のFIX製剤の1週当たり平均投与量
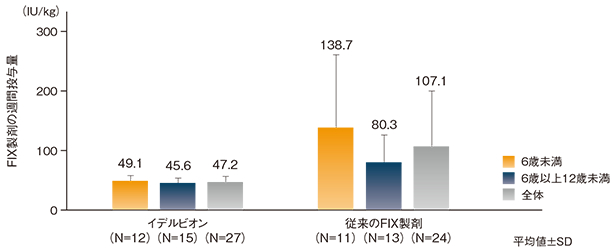
3. 出血時の止血に対する有効性
1)止血が得られるまでのイデルビオン投与回数(副次評価項目)
有効性解析集団(27例)において、治療を要した出血エピソード数は合計106件であった。このうち103件はイデルビオンの1回又は2回投与で止血が得られ、出血エピソードに対する治療成功確率※[95%信頼区間(CI)]は97.2(92.0、99.0)%であった。
※:1~2回の投与で止血を得られる確率。繰り返し測定モデルにより求めてパーセント値で表した。
止血を得るのに要したイデルビオンの投与回数
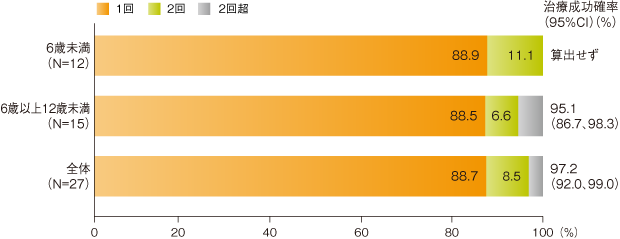
2)出血に対する止血効果の臨床評価(その他の評価項目)
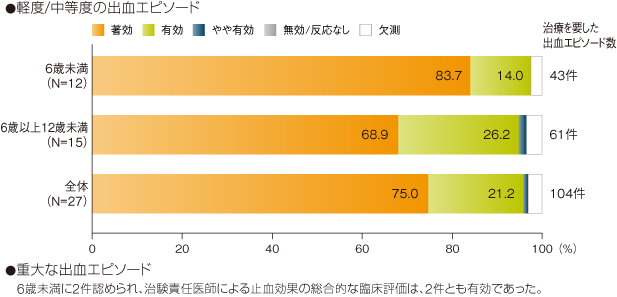
有効性解析集団(27例)において、治験責任医師による出血エピソードに対するイデルビオンの止血効果の臨床評価は、軽度又は中等度の出血エピソードの大多数が「著効」(78/104件、75.0%)もしくは「有効」(22/104件、21.2%)であった。重大な出血エピソードは6歳未満に2件認められ、止血効果の臨床評価は2件とも「有効」であった。
治験責任医師による出血に対する止血効果の総合的な臨床評価
[評価基準]
軽度~中等度の出血時
| 著効 | 止血の達成のための追加投与が不要である。初回投与24時間後に、他覚的な出血症状(腫脹、圧痛、及び/又は筋骨格系の出血の場合は可動域の減少)が明らかに改善した。 |
|---|---|
| 有効 | 止血の達成のために2回目の投与を必要とした。初回投与24時間後に、出血症状が改善した。 |
| やや有効 | 止血の達成のために2回超の投与を必要とした。初回投与24時間後に、出血症状がわずかに改善した。 |
| 無効/反応なし | 止血の達成のために他のFIX製剤又は血漿製剤の投与を必要とした。初回投与24時間後に、改善がなかった、又は症状の悪化(出血症状)を認めた。 |
重度又は生命を脅かす出血時
| 著効 | その他の止血処置を実施しなくとも、止血が正常(非血友病患者における同程度の出血で予想される止血の達成)と臨床的に明らかに違わなかった。 |
|---|---|
| 有効 | その他の止血処置を実施しなくとも、量的及び/又は質的に、正常~軽度の止血の異常(軽度のoozing、非血友病患者との比較における失血量の増加と止血までの時間の延長)を示した。 |
| やや有効 | 量的及び/又は質的に、中等度の止血の異常(制御が困難な中等度の出血)を示した。 |
| 無効/反応なし | 量的及び/又は質的に、重度の止血の異常(制御が困難な重度の出血)を示し、かつ/又は、予想された以上に他のFIX製剤、クリオプレシピテート又は血漿製剤の投与による追加の止血処置を必要とした。 |
4. 周術期止血管理に対する有効性(その他の評価項目)
2例が2件の手術を受けた。内訳は、1例が2本の抜歯、もう1例が歯の膿瘍後の4本の抜歯であった。 2本抜歯の症例は、手術前の術前投与及び術後9日の定期補充療法の2回のイデルビオン投与を受けた。
膿瘍後の4本抜歯の症例は、手術前の術前投与、術後3日及び10日の定期補充療法、並びに術後6日に追加の、合計4回のイデルビオン投与を受けた。
止血管理に対する反応の評価は、創閉鎖時及び術後7日目の時点で「著効」又は「有効」と評価された。他の止血措置や輸血を必要とした症例はなかった。
[評価基準]
| 著効 | 臨床的止血が正常(非血友病患者の同様の手術で予想される止血達成)と明らかに違わない、又は、術中失血量が予想される失血量の120%を超えない。 |
|---|---|
| 有効 | 量的及び/又は質的に、正常~軽度の止血の異常(軽度のoozing、非血友病患者との比較における失血量の増加と止血までの時間の延長)を示す、又は、術中失血量が予想される失血量の120%より多く130%以下である。 |
| やや有効 | 量的及び/又は質的に、中等度の止血の異常(制御が困難な中等度の出血)を示し、術中失血量が「有効」で規定した基準より多い。 |
| 無効/反応なし | 量的及び/又は質的に、重度の止血の異常(制御が困難な重度の出血)を示し、かつ/又は、完全な止血のためには他のFIX製剤又は血漿製剤の投与による追加の止血処理を必要とする。 |
(5)安全性
1)インヒビター及び抗体(主要/副次評価項目)
安全性解析集団においてインヒビターの発現率は0%(95%CI:0.0、12.8%)であった。本剤又はチャイニーズハムスター卵巣(CHO)宿主細胞由来タンパク質に対する抗体の発現が報告された症例はなかった。
2)有害事象及び副作用(副次評価項目)
安全性解析集団27例中26例(96.3%)に152件の有害事象が認められたが、イデルビオン投与との因果関係はないと判断された。主な有害事象は、発熱[9例(33.3%)、14件]、挫傷[5例(18.5%)、9件]及び鼻咽頭炎[4例(14.8%)、6件]などであった。また、ほぼ全ての有害事象の重症度は軽度又は中等度であった。重篤な有害事象は、前腕骨折(1例)、関節痛(1例、2件)、鼡径部痛及び頭部損傷(1例)及び舌損傷(1例)であったが、イデルビオン投与との因果関係はないと判断された。投与中止に至った症例、死亡例はなかった。
- Négrier C et al.: Haemophilia. 2016; 22(4): e259-e266
本研究はCSLベーリングの支援により行われ、本論文著者のうち4名はCSLベーリングから講演料、コンサルタント料などを受け取っており、本論文著者のうち4名はCSLベーリングの社員である。 - 社内資料:小児血友病B患者を対象とした国際多施設共同非盲検第Ⅲ相試験(3002試験)(承認時評価資料)
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、緩徐に静脈内に注射する。
通常、1回体重1kg当たり50国際単位を投与するが、患者の状態に応じて適宜増減する。
定期的に投与する場合、通常、体重1kg当たり35~50国際単位を7日に1回投与する。また、患者の状態に応じて、体重1kg当たり75国際単位の14日に1回投与に変更することもできる。さらに、14日に1回投与し、6ヵ月以上状態が安定している12歳以上の患者では、体重1kg当たり100国際単位の21日に1回投与に変更することもできる。なお、いずれの投与間隔においても投与量は適宜調節するが、7日又は14日に1回投与の場合は1回体重1kg当たり75国際単位を、21日に1回投与の場合は1回体重1kg当たり100国際単位を超えないこと。
9. 特定の背景を有する患者に関する注意(一部抜粋)
9.7 小児等
9.7.1 12歳未満の小児
投与量の調節について適宜検討すること。12歳未満の患者では、成人よりも高い投与量が必要になる可能性がある。
[電子添文の16.1.2参照]
2024年6月改訂