開発の経緯
CSLベーリング社により開発された人C1-インアクチベーター(C1-INH)濃縮製剤であるベリナートP静注用は、ヒト血漿由来で高度に精製し、パスツリゼーション及びナノフィルトレーションされた製品です。本製剤は、1979年にドイツで遺伝性血管性浮腫(HAE)発作の急性期治療における静脈内投与用の非パスツリゼーション製剤として初めて承認され、現在では他のヨーロッパ諸国のみならず米国、日本、及び世界中の国でこの適応症で承認されています。1985年にはパスツリゼーション製剤が販売され、2011年にはナノフィルトレーションが新たにウイルス除去ステップとして導入されました。
静脈内投与に必要なベリナートP静注用の必要注入量を減少させるため、溶解時の濃度が10倍となる製剤が開発され、カナダ(2014年12月)及び欧州連合22ヵ国でHAE発作の急性期静脈内投与用のBerinert 1500※として承認されました。静脈内投与製剤は、HAE発作の発症抑制に対しては実用面での制限となります。そこで、HAE発作の発症抑制及び患者の利便性とコンプライアンスの向上を目的として、皮下投与用製剤であるベリナート皮下注用を開発しました。皮下投与用製剤は米国(2017年6月)、カナダ(2017年9月)及び欧州連合等、30ヵ国以上の国・地域で承認されています。本剤は、ヒト血漿由来のC1-INH濃縮製剤であり、ウイルス不活化/除去工程を経て、無菌ろ過及び凍結乾燥して製造されます。
日本においては、国内第Ⅲ相臨床試験(CSL830_3003試験)で日本人被験者のHAE発作の発症抑制におけるベリナート皮下注用60 IU/kg投与の有効性が示され、ピボタル試験である海外第Ⅲ相臨床試験[COMPACT試験(CSL830_3001試験)]の結果と同様でした。日本人被験者で認められた安全性は外国人被験者で認められた安全性と一致しており、新たな安全性の懸念は示されませんでした。そのため2022年1月に製造販売承認申請を行い、2022年9月に「遺伝性血管性浮腫の急性発作の発症抑制」に対する製造販売承認を取得しました。
※本邦未承認
特徴(特性)
- 本剤は乾燥濃縮人C1-インアクチベーター製剤であり、溶解後にはC1-インアクチベーターを500 IU/mL含有している。
- 遺伝性血管性浮腫(HAE)患者に対し定期的に補充(週2回皮下投与)することで、HAE急性発作の発症を抑制する。
- 皮下注射であるため、患者の自己投与及び在宅投与が可能である。
- 人C1-インアクチベーターは分子量105kDaの糖蛋白であり、補体成分C1r及びC1sの他、血液凝固・線溶系の第Ⅻa因子、カリクレインに対して阻害作用を有する。
- HAE患者を対象としたCOMPACT試験において、期間で調整したHAE発作頻度(最小二乗平均)はプラセボ投与4.03回/月、本剤60 IU/kg投与0.52回/月であり、プラセボ投与に対する本剤60 IU/kg投与の優越性が検証された(p<0.001、混合効果モデル)。また、期間で調整したHAE発作頻度(中央値)はプラセボ投与3.75回/月、本剤60 IU/kg投与0.29回/月であり、減少率の中央値は95.1%であった。(海外データ)
- HAE患者を対象としたCOMPACT試験において、期間で調整したレスキュー薬の使用頻度(最小二乗平均)はプラセボ投与3.89回/月から本剤60 IU/kg投与で0.32回/月に減少し、減少率の中央値は100%であった。(海外データ)
- 本剤60 IU/kgの週2回投与シミュレーションによるC1-インアクチベーター活性の薬物動態パラメータにおいて、Ctrough(%)の幾何平均値(95%信頼区間)は48.0(25.1, 102)であった。
- HAE患者を対象とした国内第Ⅲ相臨床試験(3003試験)において、本剤治療期(60 IU/kg)の期間で調整したHAE発作頻度の平均値(標準偏差)及び中央値(範囲)は、導入期の3.691(1.0909)回/月及び3.581(2.03, 5.64)回/月に対してそれぞれ0.295(0.4815)回/月及び0(0, 1.32)回/月であった。被験者内で比較した導入期と本剤治療期の発作頻度の差は統計的に有意であった(探索的p値[名目上のp値]=0.004、両側Wilcoxon符号順位検定)。
- 重大な副作用として、ショック、アナフィラキシーがあらわれることがある。
主な副作用として、注射部位反応(紅斑、疼痛、内出血、反応、硬結、腫脹、出血、血腫、そう痒感、発疹、分泌物、熱感、冷感、浮腫、じん麻疹)が認められた。詳細は、電子添文の副作用の項及び臨床成績の項の安全性の結果を参照すること。
ベリナート皮下注用の作用機序
C1-インアクチベーター(C1-INH)は分子量105kDaの糖蛋白であり、プロテアーゼC1r及びC1sを不活化することで補体活性化経路を阻害します。また、血液凝固第Ⅻa因子、血漿カリクレインに対して阻害作用を有します。ベリナート皮下注用は遺伝性血管性浮腫において欠如しているC1-INHを補充することにより治療効果を示します1,2)。
■凝固系、カリクレイン・キニン系、線溶系、補体系とC1-インアクチベーター(C1-INH)の作用点3)
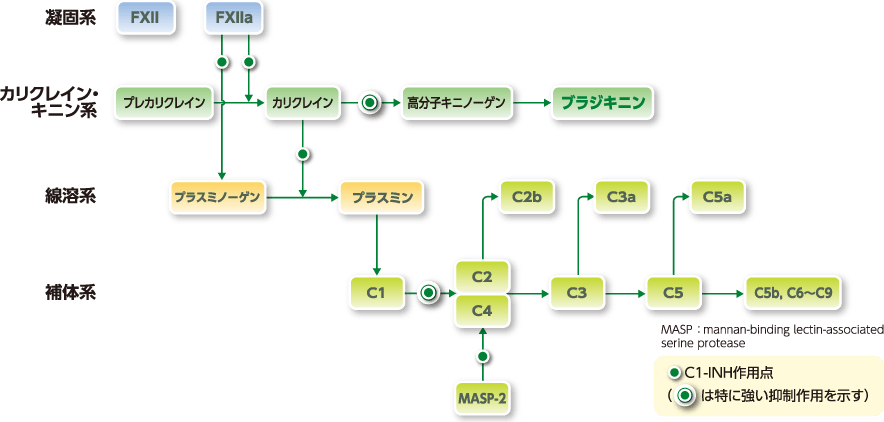
1)Agostoni A, et al.:J Allergy Clin Immunol. 2004;114(3):S51-131
利益相反:著者にAventisベーリング(CSLベーリング社の前身会社)よりコンサルト料、謝礼、研究費を受領している者が含まれる。
本論文の著者のうち2人はAventisベーリングの社員である。
2)Davis AE 3rd, et al.:Mol Immunol. 2008;45(16):4057-4063
3)堀内孝彦:FOCUS「補体」シリーズ(第7回)日本補体学会. 2018;34-38 より改変
薬物動態
母集団薬物動態解析①(外国人データ)4)
ベリナート皮下注用60 IU/kgを週2回皮下投与したときの定常状態でのC1-インアクチベーター(C1-INH)活性-時間プロファイルを、臨床開発プログラムの併合データの母集団薬物動態解析における最終モデルを用いて、遺伝性血管性浮腫(HAE)被験者1,000例でシミュレーションしました。定常状態における薬物動態パラメータは、Cmax 60.7%、Tmax 58.7時間、Ctrough 48.0%でした。
■本剤60 IU/kgを週2回皮下投与したときの定常状態でのC1-INH活性プロファイル
(シミュレーション結果)
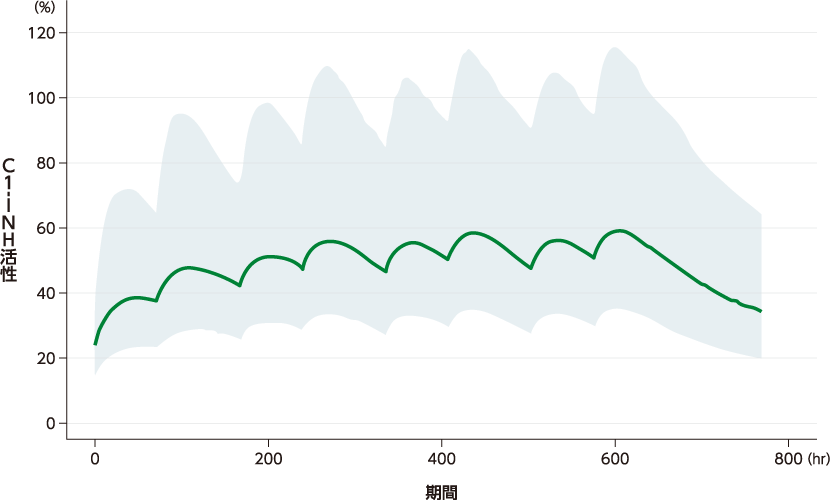
■本剤60 IU/kgを週2回皮下投与したときの定常状態でのC1-INH活性の薬物動態パラメータ
(シミュレーション結果)
| Cmax(%) | Tmax(hr) | AUC0-τ(%・hr) | Ctrough(%) | t1/2(hr) | |
|---|---|---|---|---|---|
| 幾何平均値 (95%信頼区間) | 60.7 (31.8, 128) | 58.7※ (23, 134) | 2540 (837, 7670) | 48.0 (25.1, 102) | 68.7※ (24.0, 251) |
※:中央値
Cmax:定常状態での最高血漿中C1-INH活性、Tmax:Cmax 到達時間、AUC0-τ:定常状態での投与後0時間から投与間隔終了時点までの血漿中C1-INH活性-時間曲線下面積、Ctrough:定常状態での最低(トラフ)血漿中C1-INH活性、t1/2:見かけの消失半減期
その他の薬物動態パラメータの平均値(95%CI)は、分布容積注)0.05(0.04, 0.06)L/kg、相対的バイオアベイラビリティ43(35.2, 50.2)%、クリアランス注)0.830(0.727, 0.942)IU/hr・%でした。
4)社内資料:臨床薬理試験(CTD 2.7.2.3)
注)体重の中央値80.7kgに基づき算出
本解析には一部承認外の用量(40 IU/kg週2回皮下投与)が含まれますが、承認の範囲外の使用を推奨する意図はございません。母集団薬物動態解析として用いた用量であり、原著との不整合が生じることを防ぐため、承認外用量を含む内容を記載しました。
母集団薬物動態解析②:曝露-反応解析(外国人データ)4,5)
臨床試験で得られた薬物動態プロファイルの実測値と母集団薬物動態解析のシミュレーション結果は類似していることが示され、ベリナート皮下注用40 IU/kg及び60 IU/kgを週2回皮下投与した場合、いずれの用量でも定常状態でC1-インアクチベーター(C1-INH)活性のトラフ値が、HAE発作の抑制が示唆される閾値である40%6)を超えることが示されました。
そこでC1-INH活性と臨床的反応性の評価項目の相関性を評価するため、COMPACT試験でランダム化されベリナート皮下注用を投与された遺伝性血管性浮腫(HAE)被験者90例全例のデータを用いて実施した、母集団薬物動態解析法に基づく曝露-反応解析の結果を以下に示します。
HAE発作の相対リスクのモデルシミュレーションから、本剤40 IU/kg投与後のCtroughの幾何平均(40.2%)では、HAE発作の相対リスクが無治療と比較して70%減少すると予測されました。同様に、本剤60 IU/kg投与後のCtroughの幾何平均(48.0%)では、HAE発作の相対リスクが81%減少すると予測されました。また、このモデルシミュレーションから、HAE発作の相対リスクはC1-INH活性33.1%で50%減少、C1-INH活性40.3%で70%減少、C1-INH活性63.1%で90%減少すると予測されました。本解析により、本剤投与後にC1-INH活性は用量依存的に上昇し、本剤40 IU/kg投与よりも60 IU/kg投与でHAE発作の相対リスクが減少することが予測されたため、本剤の用法及び用量として、1回60 IU/kgの週2回皮下投与を設定することが適切と考えられました。
■HAE発作の相対リスクとC1-INH活性トラフ値の関連性
(ベースラインのC1-INH活性の幾何平均25.4%との比較)(シミュレーション結果)
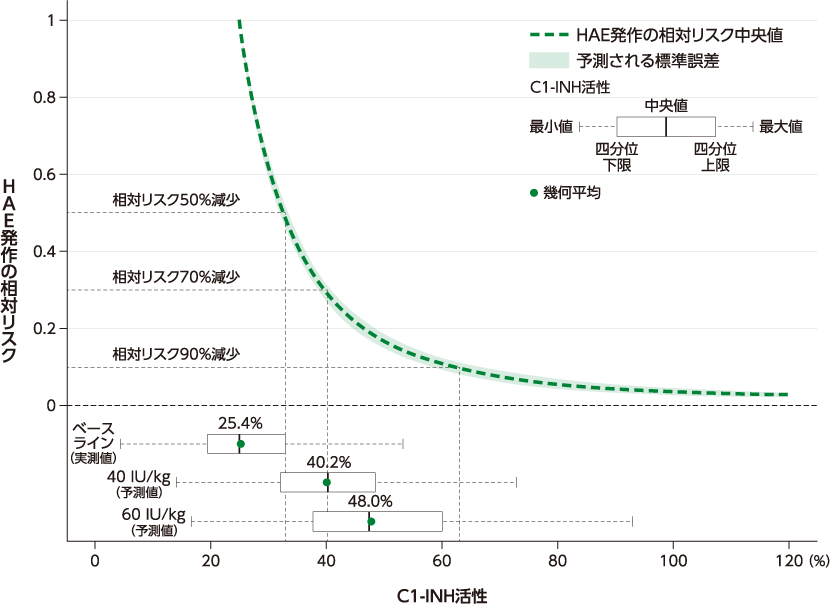
Ctrough:定常状態での最低(トラフ)血漿中C1-INH活性
4)社内資料:臨床薬理試験(CTD 2.7.2.3)
5)Zhang Y, et al.:CPT Pharmacometrics Syst Pharmacol. 2018;7(3):158-165
利益相反:本試験はCSLベーリングより資金助成を受けた。著者にCSLベーリングよりコンサルト料、謝礼、
研究費を受領している者が含まれる。本論文の著者のうち6人はCSLベーリングの社員である。
6)Späth PJ, et al.:Complement. 1984;1(3):147-159
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。