国内第III相臨床試験:3003試験1,2)
1)社内資料:国内第III相試験(CSL830_3003)(CTD 2.7.6.5)(承認時評価資料)
2)Fukuda T, et al. Allergol Int. 2023; 72(3): 451-457
利益相反:本試験はCSLベーリングより資金助成を受けた。
著者にCSLベーリングより謝礼を受領している者が含まれる。
本論文の著者のうち4人はCSLベーリングの社員である。
試験概要
目的
日本人被験者を対象とし、遺伝性血管性浮腫(HAE)の予防を目的としてベリナート皮下注用を皮下投与したときの有効性及び薬物動態を評価する。
対象
HAE 1型又は2型と確定診断された12歳以上の日本人HAE患者9例
試験デザイン
非盲検、多施設共同、非ランダム化、単一群、第III相試験
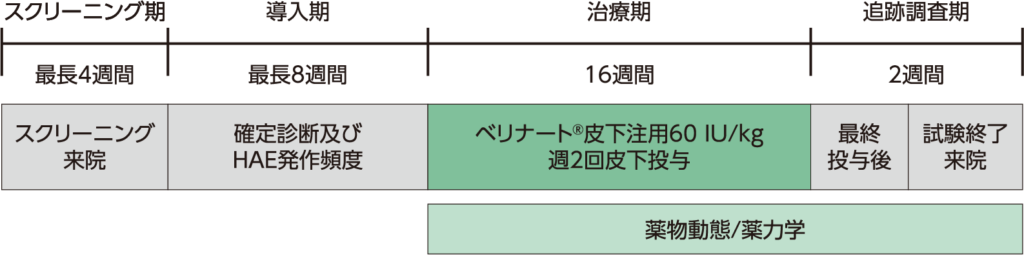
方法
スクリーニング期、導入期、治療期及び薬物動態/薬力学用血液検体採取のための最終投与後の追跡調査期の4パートで構成された。
- スクリーニング期(最長4週間)
スクリーニング来院前(又は予防治療の開始前)3ヵ月間のうち連続する2ヵ月間でHAE発作が4回以上発現したことが医療記録に記録されていた場合にスクリーニングを完了し、その他の選択基準を満たした場合に被験者を導入期に組み入れた。 - 導入期(最長8週間)
HAE発作が導入期の最初の2週間に1回以上、又は連続する4週間に2回以上発現し、HAE1型又は2型と確定診断された被験者のみが、治療期へ移行できた。 - 治療期(16週間)
ベリナート皮下注用60 IU/kgを週2回16週間、腹部へ皮下投与した。 - 追跡調査期(2週間)
試験終了来院は、治療期の終了又は被験者が試験を中止した場合は試験中止から約2週間後に実施した。
薬物動態/薬力学用血液検体は、スクリーニング、治療期のWeek 1(Day 1の本剤投与前)、3、7、11及び16、Week 16の最終投与の3日、5日、8日後、試験終了来院で採取した。
評価項目
| 主要評価項目 | 期間で調整したHAE発作頻度、Week16での最終投与後のC1-インアクチベーター(C1-INH)活性 |
|---|---|
| 副次評価項目 | HAE発作頻度が導入期と比較して50%以上相対的に減少した被験者(レスポンダー)の割合、又は70%以上及び90%以上相対的に減少した被験者の割合、期間で調整したレスキュー薬の使用頻度の導入期と比較した相対的減少、報告された有害事象の発現例数及び発現件数で評価する本剤の安全性及び忍容性、本剤治療期のWeek 3、7、11及び16のC1-INH活性のトラフ値の平均値、並びに本剤治療期のC1-INH活性 等 |
解析計画
有効性の主要評価項目は、Full Analysis Set(FAS)とPer-protocol(PP)Analysis Setに基づき解析した。主解析にFASを用い、副次解析にPP Analysis Setを用いた。その他の有効性に関するデータはすべてFASに基づき評価した。
有効性の主解析として要約統計量を示した。治験責任医師がHAE発作症例報告書に記入したHAE発作に基づいた。本剤投与中の有効性評価期及び導入期の期間で調整した(1ヵ月あたりの)HAE発作頻度の要約統計量を示した。導入期と有効性評価期の発作頻度の差の被験者内比較は、両側有意水準5%のWilcoxonの符号順位検定を用いて探索的に検定した。 薬物動態/薬力学の解析は、それぞれPharmacokinetic Analysis Set及びPharmacodynamic Analysis Setを用いて要約した。Pharmacokinetic Analysis Setは、FASのすべての被験者のうち、本剤を投与され、血漿中濃度データが得られている被験者で構成され、薬物動態パラメータの推定及び解析に使用した。Pharmacodynamic Analysis Setは、血液を採取し、C4タンパク量の解析結果が得られたSafety Analysis Set(SAF)の被験者で構成された。
薬物動態パラメータ及びCtrough値は、Week 16での最終投与後に測定したC1-INH活性に基づき要約した。スクリーニング時、Week 1の投与前、本剤治療期のWeek 3、7、11及び16のC1-INH活性、C1-INHタンパク量及びC4タンパク量について要約統計量を示した。
安全性の解析は、本剤治療期に移行し本剤を1回以上投与されたすべての被験者で構成されるSafety Analysis Set(SAF)を用いて要約した。有害事象は、その有害事象が発現した被験者数、被験者の割合及び事象の件数を要約した。また、投与で調整した発現率及び曝露量で調整した発現率を示した。有害事象、副作用、注射部位反応などの有害事象を要約した。
患者背景
| FAS(N=9) | ||
|---|---|---|
| 年齢、歳 | 平均値[標準偏差] | 37.9[11.43] |
| 最小値,最大値 | 17,50 | |
| 中央値 | 41.0 | |
| 年齢層、n(%) | 12歳以上17歳未満 | 0 |
| 17歳以上65歳未満 | 9(100.0%) | |
| 12歳以上20歳未満 | 1(11.1%) | |
| 20歳以上65歳未満 | 8(88.9%) | |
| 65歳以上 | 0 | |
| 性別、n(%) | 女性 | 6(66.7%) |
| 男性 | 3(33.3%) | |
| 人種、n(%) | 日本人 | 9(100.0%) |
| 体重(kg) | 平均値[標準偏差] | 68.7[8.32] |
| 最小値,最大値 | 57, 79 | |
| 中央値 | 73.0 | |
| BMI(kg/m2) | 平均値[標準偏差] | 25.83[3.15] |
| 最小値,最大値 | 21.51,30.00 | |
| 中央値 | 26.03 | |
| HAE病型、n(%) | 1型 | 8(88.9%) |
| 2型 | 1(11.1%) | |
| スクリーニング前又は 経口予防薬の開始前3ヵ月間に 発現したHAE発作回数 | 平均値[標準偏差] | 11.2[10.97] |
| 最小値,最大値 | 4,40 | |
| 中央値 | 9.0 | |
| 第一,第三四分位数 | 7.0,9.0 | |
有効性
期間で調整したHAE発作頻度主要評価項目(有効性)
期間で調整したHAE発作頻度の平均値(標準偏差)は、導入期3.691(1.0909)回/月、治療期0.295(0.4815)回/月であり、被験者内で比較した導入期と治療期の差において有意差が示されました(探索的p値[名目上のp値]=0.004、両側Wilcoxon符号順位検定)。また発作頻度の中央値(範囲)は、導入期3.581(2.03、5.64)回/月、治療期0(0、1.32)回/月でした。期間で調整したHAE発作頻度の相対的減少の平均値(標準偏差)は89.3%(18.02%)(相対的減少の中央値:100%)でした。
期間で調整した1ヵ月あたりのHAE発作頻度(FAS)
| 導入期(N=9) | 治療期(N=9) | 被験者内比較: 導入期-治療期 | |
|---|---|---|---|
| 平均値(標準偏差) | 3.691(1.0909) | 0.295(0.4815) | −3.396(1.3788) |
| 最小値,最大値 | 2.03,5.64 | 0.00,1.32 | −5.64,−1.35 |
| 中央値 | 3.581 | 0.000 | −3.581 |
| p値(名目上のp値)※ | 0.004 | ||
レスポンダー※の割合 副次評価項目
すべての被験者がレスポンダーであり、期間で調整したHAE発作頻度が導入期と比較して50%以上相対的に減少しました。
また、期間で調整したHAE発作頻度が9例中7例で70%以上、9例中6例で90%以上相対的に減少しました。
※:HAE発作頻度が導入期と比較して50%以上相対的に減少した被験者
期間で調整したHAE発作頻度が50%以上相対的に減少したレスポンダー及び
70%・90%以上相対的に減少した被験者の割合(FAS)
| HAE発作頻度の相対的減少 | 導入期-治療期の比較(N=9) |
|---|---|
| 50%以上(レスポンダー) | 9例 |
| 70%以上 | 7例 |
| 90%以上 | 6例 |
期間で調整したレスキュー薬の使用頻度 副次評価項目
期間で調整したレスキュー薬の使用頻度の平均値は、導入期4.602回/月、治療期0.295回/月でした。
期間で調整した1ヵ月あたりのレスキュー薬の使用頻度(FAS)
| 導入期(N=9) | 治療期(N=9) | |
|---|---|---|
| 平均値 | 4.602 | 0.295 |
薬物動態/薬力学
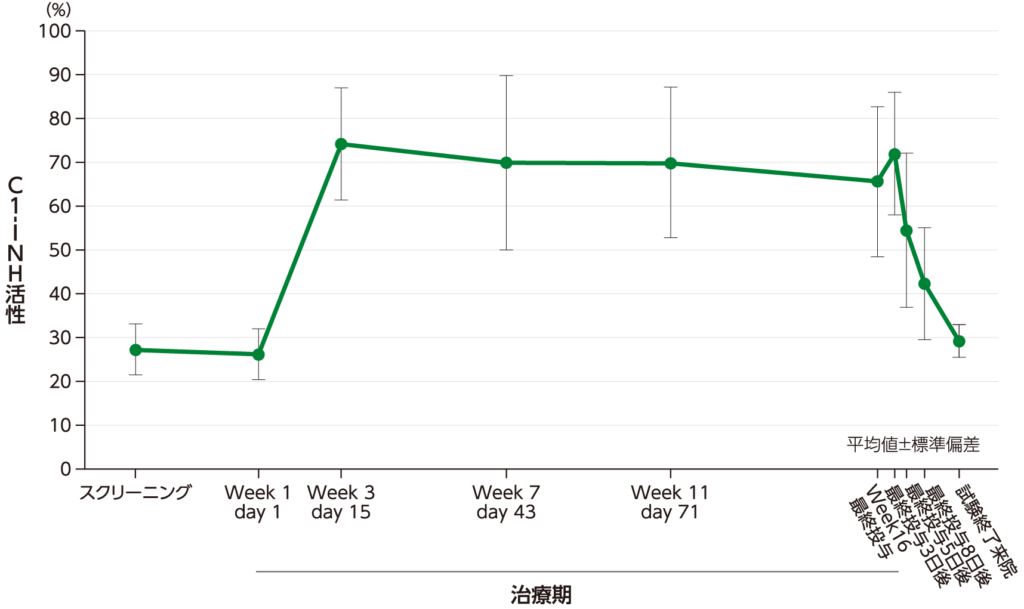
最終投与後のC1-インアクチベーター(C1-INH)活性 主要評価項目(薬物動態/薬力学)
治療期Week 16での最終投与後C1-INH活性の平均値について、Ctrough 59.8%、AUC0-τ 5,317 hr・%、AUC0-last 13,091 hr・%でした。 t1/2の平均値は約9日(225時間、範囲:167~297時間)でした。
Week 16での最終投与後のC1-INH活性の薬物動態パラメータ(n=9)(Pharmacokinetic Analysis Set)
| Ctrough(%)※ | AUC0-τ(hr・%) | AUC0-last(hr・%) | |
|---|---|---|---|
| 平均値(標準偏差) | 59.8(19.5) | 5317(1348) | 13091(3835) |
| 最小値, 最大値 | 23.0,93.7 | 2989,7672 | 8506,20760 |
| 中央値 | 61.7 | 5391 | 12286 |
AUC0-last:定常状態での投与後0時間から最終活性定量可能時間までの血漿中C1-INH活性-時間曲線下面積
※:最終投与前の濃度
C1-INH活性の平均値(±標準偏差)の推移
安全性
有害事象は9例中7例(77.8%)に発現し、副作用は9例中3例(33.3%)に発現しました。
主な副作用は、注射部位紅斑、注射部位反応、注射部位疼痛、倦怠感が9例中各1例(11.1%)に発現しました。
重篤な有害事象、試験中止に至った有害事象、死亡例は認められませんでした。
有害事象の概要
| SAF(N=9) | |||
| 例数(%) | 件数 | 件/人年※ | |
| 有害事象 | 7(77.8%) | 109 | 37.56 |
| 副作用 | 3(33.3%) | 62 | 21.36 |
| 重篤な有害事象 | 0(0%) | 0 | 0 |
| 試験中止に至った有害事象 | 0(0%) | 0 | 0 |
| 死亡 | 0(0%) | 0 | 0 |
SAF:Safety Analysis Set
副作用
| SAF(N=9) | |||
| 例数(%) | 件数 | 件/人年※ | |
| 副作用 | 3(33.3%) | 62 | 21.36 |
| 注射部位紅斑 | 1(11.1%) | 25 | 8.61 |
| 注射部位反応 | 1(11.1%) | 16 | 5.51 |
| 注射部位疼痛 | 1(11.1%) | 2 | 0.69 |
| 倦怠感 | 1(11.1%) | 19 | 6.55 |
※:(有害事象の件数)/(本剤への曝露期間[日])/365.25日
SAF:Safety Analysis Set
MedDRA version 23.1