2.禁忌(次の患者には投与しないこと) 本剤の成分に対し過敏症の既往歴のある患者
本試験には一部承認外の用量(40 IU/kg週2回皮下投与)を投与した症例が含まれるため、承認の範囲内の症例群のみに限定し、一部改変しました。
海外第Ⅲ相臨床試験:COMPACT試験(海外データ)1-3)
1)社内資料:海外第Ⅲ相試験(CSL830_3001)(CTD2.7.6.3)(承認時評価資料)
2)Longhurst H, et al.:N Engl J Med. 2017;376(12):1131-1140
利益相反:本試験はCSLベーリングより資金助成を受けた。著者にCSLベーリングよりコンサルト料、謝礼、
研究費を受領している者が含まれる。本論文の著者のうち7人はCSLベーリングの社員である。
3)Lumry WR, et al.:J Allergy Clin Immunol Pract. 2018;6(5):1733-1741
利益相反:本試験はCSLベーリングより資金助成を受けた。著者にCSLベーリングよりコンサルト料、謝礼、
研究費を受領している者が含まれる。本論文の著者のうち4人はCSLベーリングの社員である。
試験概要
目的
遺伝性血管性浮腫(HAE)の予防を目的としてベリナート皮下注用を皮下投与したときの有効性を評価し、2用量で皮下投与したときの有効性を比較する。
対象
HAE 1型又は2型と確定診断された12歳以上のHAE患者90例
試験デザイン
多施設共同、ランダム化、二重盲検、プラセボ対照、クロスオーバー、第Ⅲ相試験(検証試験)
方法
スクリーニング期、導入期、治療期1及び治療期2の4パートで構成された。
- スクリーニング期(最長4週間)
スクリーニング来院前3ヵ月以内の連続する2ヵ月間でHAE発作が4回以上医療記録に記載されている者を導入期に組み入れた。 - 導入期(最長8週間)
組入れ後2週間以内に1回以上又は導入期中の連続する4週間に2回以上HAE発作が発現した被験者を適格被験者として治療期に組み入れた。 - 治療期1及び治療期2(各16週間)
適格被験者を以下の4つの投与シークエンスのいずれかに1:1:1:1 でランダムに割り付けた。
40 IU/kg投与シークエンス
プラセボ(0.12 mL/kg)を週2回16週間皮下投与後、ベリナート皮下注用40 IU/kg(0.08 mL/kg)を週2回16週間皮下投与
又は
ベリナート皮下注用40 IU/kg(0.08 mL/kg)を週2回16週間皮下投与後、プラセボ(0.12 mL/kg)を週2回16週間皮下投与
60 IU/kg投与シークエンス
プラセボ(0.08 mL/kg)を週2回16週間皮下投与後、ベリナート皮下注用60 IU/kg(0.12 mL/kg)を週2回16週間皮下投与
又は
ベリナート皮下注用60 IU/kg(0.12 mL/kg)を週2回16週間皮下投与後、プラセボ(0.08 mL/kg)を週2回16週間皮下投与

評価項目
| 主要評価項目 | 期間で調整したHAE発作頻度(検証的な解析項目) |
|---|---|
| 副次評価項目 | HAE発作頻度がプラセボ投与と比較して50%以上相対的に減少した被験者(レスポンダー)の割合、期間で調整したレスキュー薬の使用頻度、有害事象、重篤な有害事象 等 |
| 探索的評価項目 | HAE発作の平均重症度、4週あたりの期間で調整したHAE発作頻度が1回未満へ減少した被験者の割合、期間で調整したHAE症状の発現日数、患者報告アウトカム質問票、C1-INH活性、C4タンパク量 等 |
解析計画
有効性の主要評価項目及び副次評価項目は、Intent-to-Treat(ITT)Population及びPer Protocol(PP)Populationに基づき解析し、ITT Populationを主解析に用いた。その他の有効性データはすべてITT Populationを用いて解析した。ITT Populationは、治験薬投与の有無に関わらず文書による同意/アセントを取得し、ランダム化されたすべての被験者で構成された。PP Populationは、ITT Populationのうち、重大な治験実施計画書からの逸脱が報告された被験者を除いたすべての被験者で構成された。混合効果モデルを用いて、階層検定手順(最初に60 IU/kg対プラセボ0.08 mL/kg、次に40 IU/kg対プラセボ0.12 mL/kg、最後に60 IU/kg対40 IU/kgを検定)に従い、期間で調整したHAE発作頻度に対する治療効果を解析した。治療効果と投与群間差の最小二乗平均を両側95%信頼区間と共に算出し、対応するp値も示した。
安全性の解析は、文書による同意/アセントの取得及びランダム化後に治験薬を1回以上投与したすべての被験者で構成されるSafety Populationを用いて実施した。有害事象、注射部位反応及び注射部位反応以外の有害事象を重症度、治験薬との因果関係、転帰及び重篤度別に投与内容ごとに記述した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
患者背景(ITT Population)
| 40 IU/kg投与 シークエンス(N=45) | 60 IU/kg投与 シークエンス(N=45) | 全体 (N=90) | ||
|---|---|---|---|---|
| 年齢、歳 | 平均値[標準偏差] | 42.4[14.41] | 36.8[14.92] | 39.6[14.85] |
| 最小値,最大値 | 12,67 | 14,72 | 12,72 | |
| 中央値 | 43.0 | 35.0 | 40.0 | |
| 性別、n(%) | 女性 | 28(62.2%) | 32(71.1%) | 60(66.7%) |
| 男性 | 17(37.8%) | 13(28.9%) | 30(33.3%) | |
| 人種、n(%) | 白人 | 40(88.9%) | 44(97.8%) | 84(93.3%) |
| 黒人又はアフリカ系米国人 | 3(6.7%) | 1(2.2%) | 4(4.4%) | |
| アジア人 | 1(2.2%) | 0 | 1(1.1%) | |
| その他 | 1(2.2%) | 0 | 1(1.1%) | |
| 体重(kg) | 平均値[標準偏差] | 82.98[23.035] | 80.15[24.577] | 81.56[23.727] |
| 最小値,最大値 | 50.0, 141.1 | 43.0, 156.8 | 43.0, 156.8 | |
| 中央値 | 80.20 | 78.00 | 78.10 | |
| BMI(kg/m2) | 平均値[標準偏差] | 29.53[7.309] | 27.65[6.811] | 28.59[7.088] |
| 最小値,最大値 | 19.7, 46.5 | 16.2, 55.7 | 16.2, 55.7 | |
| 中央値 | 28.12 | 26.12 | 27.30 | |
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
有効性
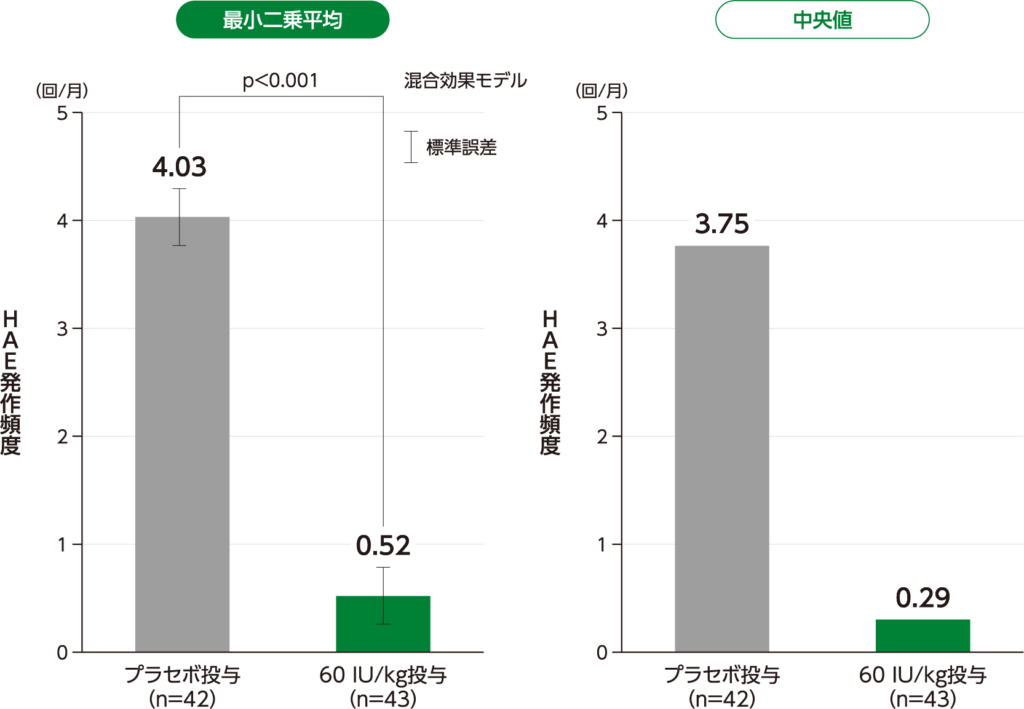
期間で調整したHAE発作頻度 主要評価項目 (検証的解析結果)
期間で調整したHAE発作頻度の最小二乗平均(標準誤差)は、60 IU/kg投与0.52(0.261)回/月であり、プラセボ投与4.03(0.263)回/ 月と比較して有意に低く(p<0.001、混合効果モデル)、60 IU/kg投与のプラセボ投与に対する優越性が検証されました。
またHAE発作頻度の中央値は、60 IU/kg投与0.29回/月、プラセボ投与3.75回/月であり、減少率の中央値は95.1%でした。
喉頭部発作の発現は、60 IU/kg投与では認められず、プラセボ投与で9例に認められました。
期間で調整したHAE発作頻度(ITT Population)(検証的解析結果)
HAE発作頻度減少率(対プラセボ投与)
| 60 IU/kg投与 | |
|---|---|
| 中央値 | 95% |
| 平均値 | 84% |
・40 IU/kg投与の結果は、承認外の用法及び用量のため削除した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
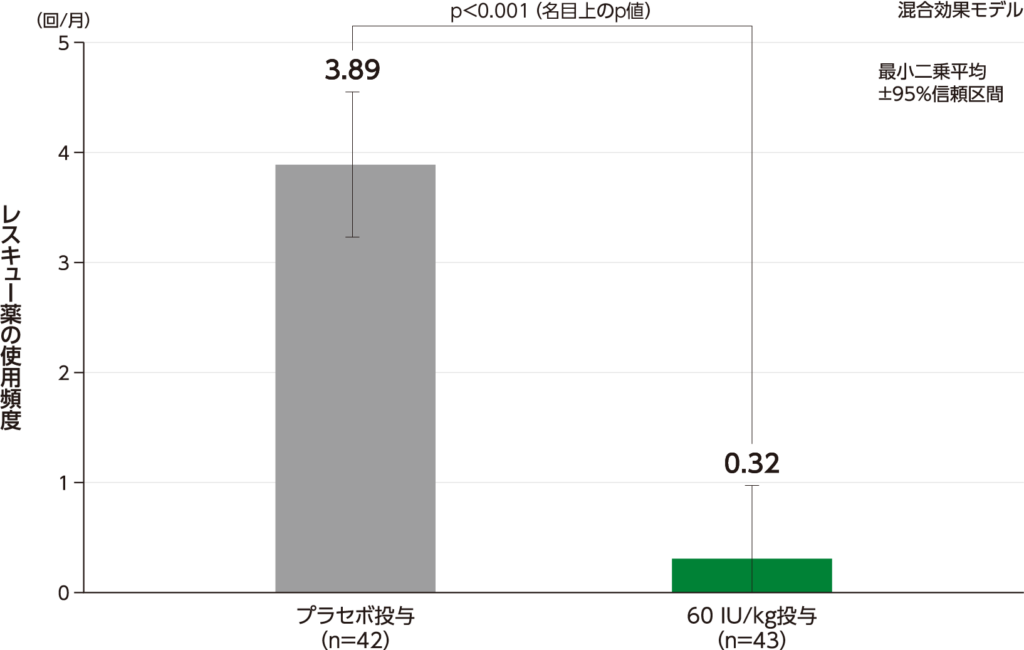
期間で調整したレスキュー薬の使用頻度 副次評価項目
期間で調整したレスキュー薬の使用頻度の最小二乗平均(95%信頼区間)は、60 IU/kg投与0.32(-0.33、0.97)回/月であり、プラセボ投与3.89(3.23、4.55)回/月と比較して有意差が示されました(p<0.001[名目上のp値]、混合効果モデル)。
期間で調整したレスキュー薬の使用頻度(ITT Population)
レスキュー薬の使用頻度減少率(対プラセボ投与)
| 60 IU/kg投与 | |
|---|---|
| 中央値 | 100% |
| 平均値 | 89% |
・40 IU/kg投与の結果は、承認外の用法及び用量のため削除した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
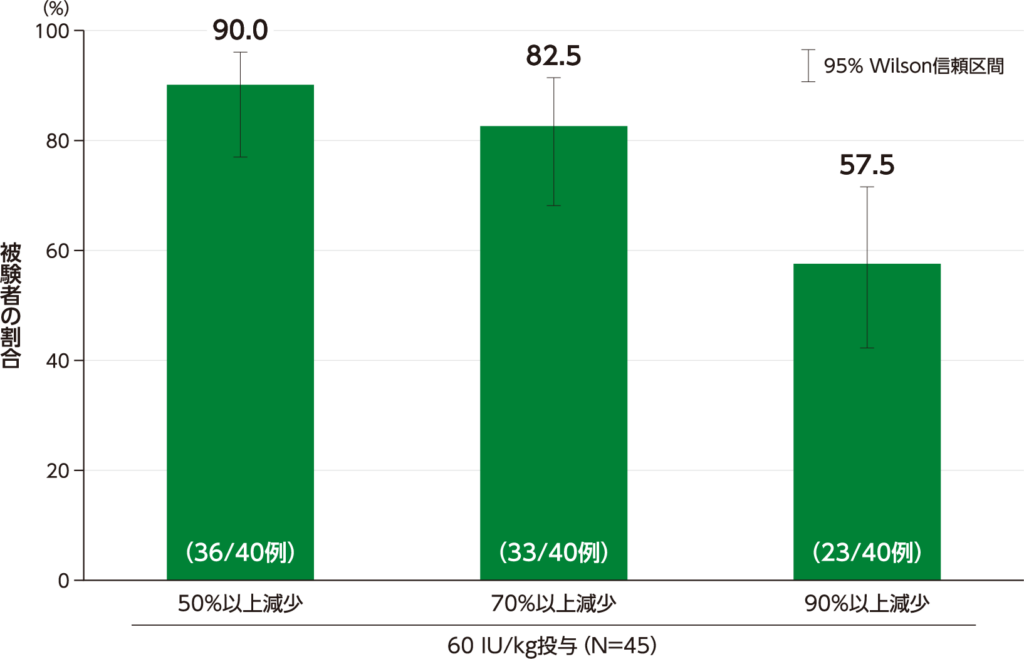
レスポンダーの割合(副次評価項目)
期間で調整したHAE発作頻度が、60 IU/kg投与でプラセボ投与と比較して50%以上相対的に減少したレスポンダーの割合(95% Wilson信頼区間)は90.0(76.9、96.0)%(36/40例)でした。70%以上及び90%以上相対的に減少した被験者の割合の解析も事前に規定されており、60 IU/kg投与でプラセボ投与と比較して70%以上相対的に減少した被験者の割合(95% Wilson信頼区間)は82.5(68.1、91.3)%(33/40例)、90%以上相対的に減少した被験者の割合は57.5(42.2、71.5)%(23/40例)でした。
期間で調整したHAE発作頻度が50%以上相対的に減少したレスポンダー及び
70%・90%以上相対的に減少した被験者の割合(ITT Population)
・40 IU/kg投与の結果は、承認外の用法及び用量のため削除した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
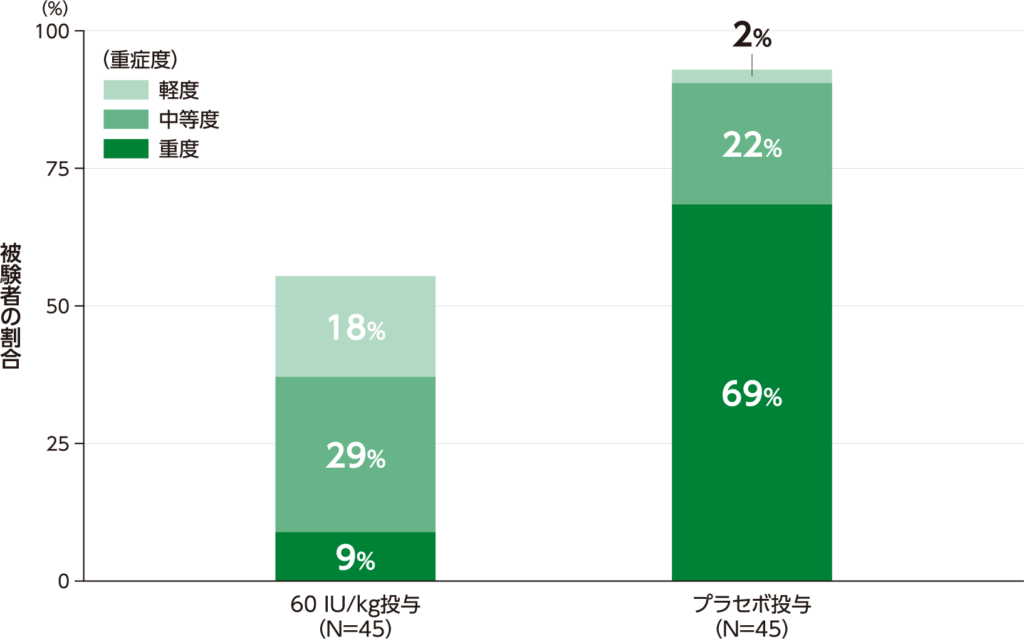
HAE発作の重症度 探索的評価項目
HAE発作の重症度[治験責任医師が3段階(軽度1、中等度2、重度3)で評価]は、重度の発作が1回以上発現した被験者の割合は、60 IU/kg投与8.9%(4/45例)、プラセボ投与68.9%(31/45例)でした。
HAE発作が発現した被験者の割合及びHAE発作の最高重症度の割合(ITT Population)
・40 IU/kg投与の結果は、承認外の用法及び用量のため削除した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
期間で調整したHAE症状の発現日数 探索的評価項目
期間で調整したHAE症状の発現日数の平均値(標準偏差)は、60 IU/kg投与1.61(4.388)日/月、プラセボ投与7.51(5.588)日/月でした。
期間で調整したHAE症状の発現日数(ITT Population)
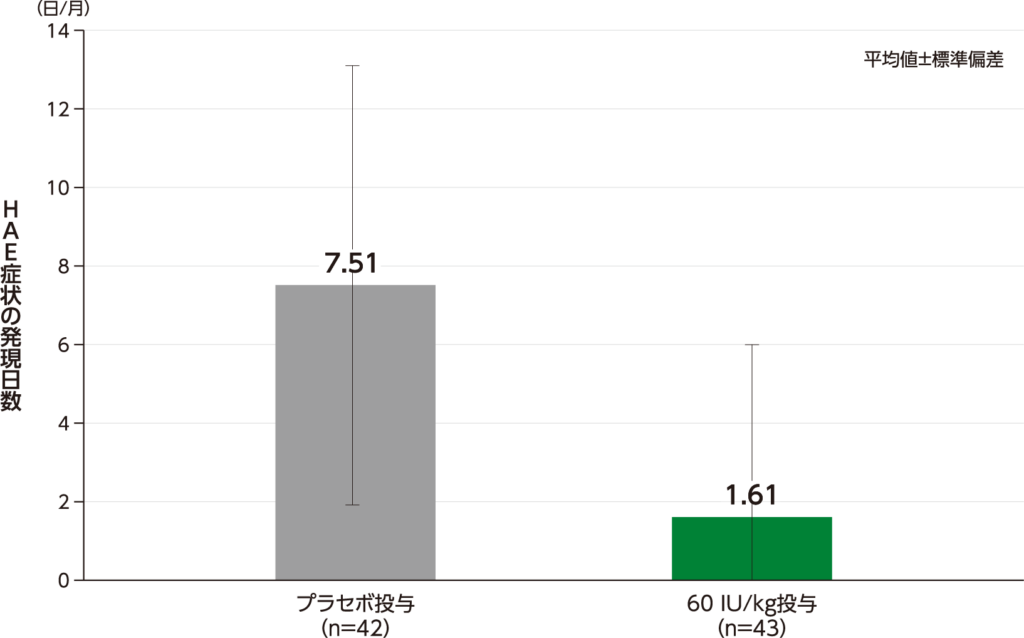
・40 IU/kg投与の結果は、承認外の用法及び用量のため削除した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
4週あたりの期間で調整したHAE発作頻度が1回未満へ減少した被験者の割合(探索的評価項目)
4週あたりの期間で調整したHAE発作頻度が1回未満へ減少した被験者の割合は、60 IU/kg投与で71.1%(32/45例)でした。
4週あたりの期間で調整したHAE発作頻度が1回未満へ減少した被験者の割合(ITT Population)
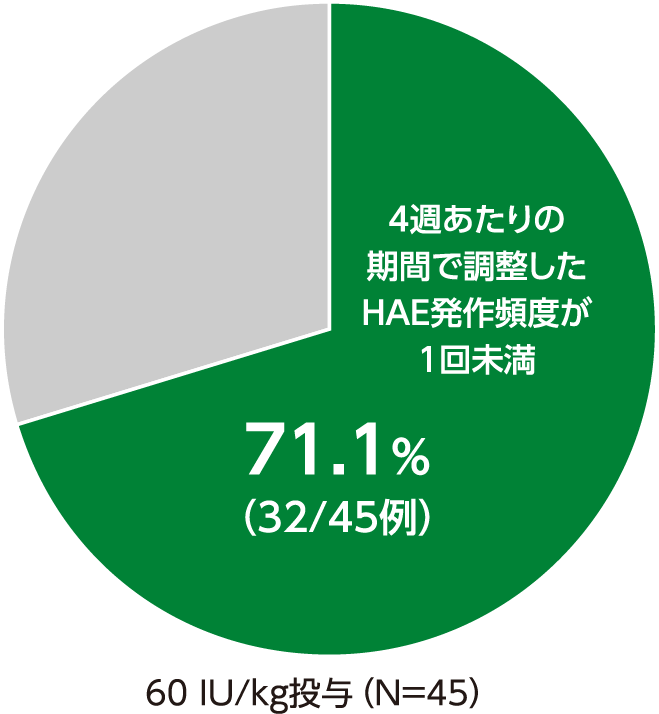
・40 IU/kg投与の結果は、承認外の用法及び用量のため削除した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
患者報告アウトカム質問票(EQ-5D、WPAI、TSQM及びHADS) (探索的評価項目)
EQ-5D、WPAI、TSQM及びHADSの各種患者アウトカム質問票について、スクリーニングから最終来院時の変化で、臨床的に意義のある最小差(MCID)以上改善した患者の割合は下図の通りでした。
臨床的に意義のある最小差(MCID)以上改善した被験者の割合
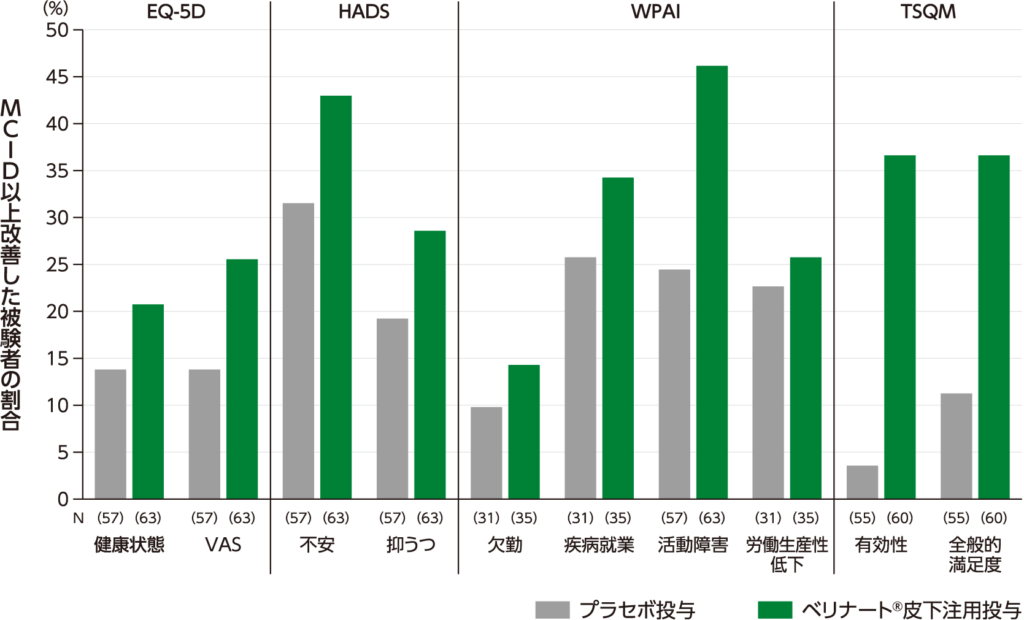
EQ-5D: European Quality of Life-5 Dimensions(全般的健康状態)
HADS: Hospital Anxiety and Depression Scale(不安及び抑うつ)
WPAI: Work Productivity and Activity Impairment(労働生産性及び活動障害)
TSQM: Treatment Satisfaction Questionnaire for Medication(治療満足度)
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
薬物動態/薬力学
C1-インアクチベーター(C1-INH)活性 探索的評価項目
定常状態でのC1-INH活性の平均値(Week 3~14)は、プラセボ投与で26.9~30.6%、60 IU/kg投与で63.4~69.0%でした。
C1-INH活性トラフ値の平均値(±標準偏差)の推移
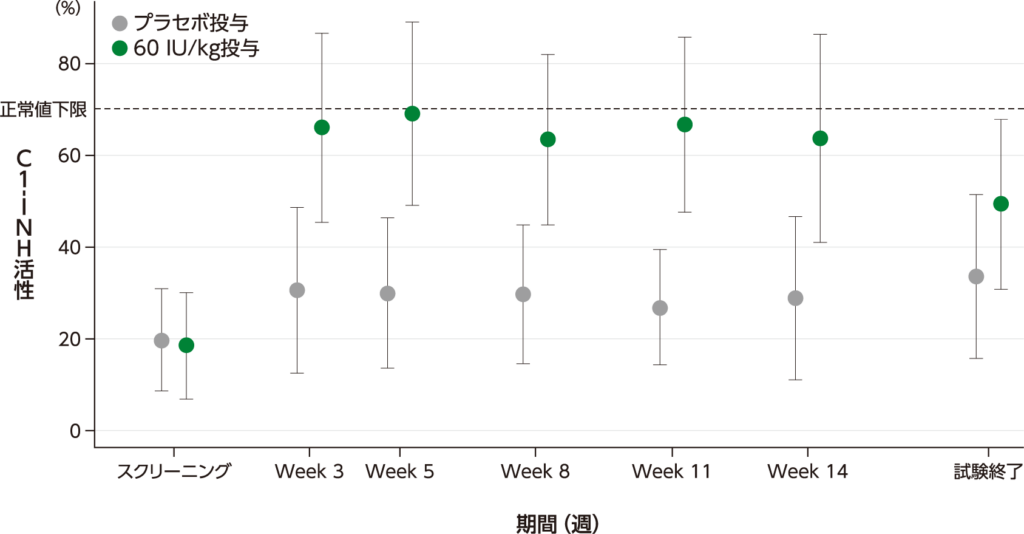
・40 IU/kg投与の結果は、承認外の用法及び用量のため削除した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
C4タンパク量 探索的評価項目
C4タンパク量の平均値(Week 3~14)は、プラセボ投与で8.11~9.03 mg/dL、60 IU/kg投与で17.8~18.7 mg/dLでした。
C4タンパク量トラフ値の平均値(±標準偏差)の推移
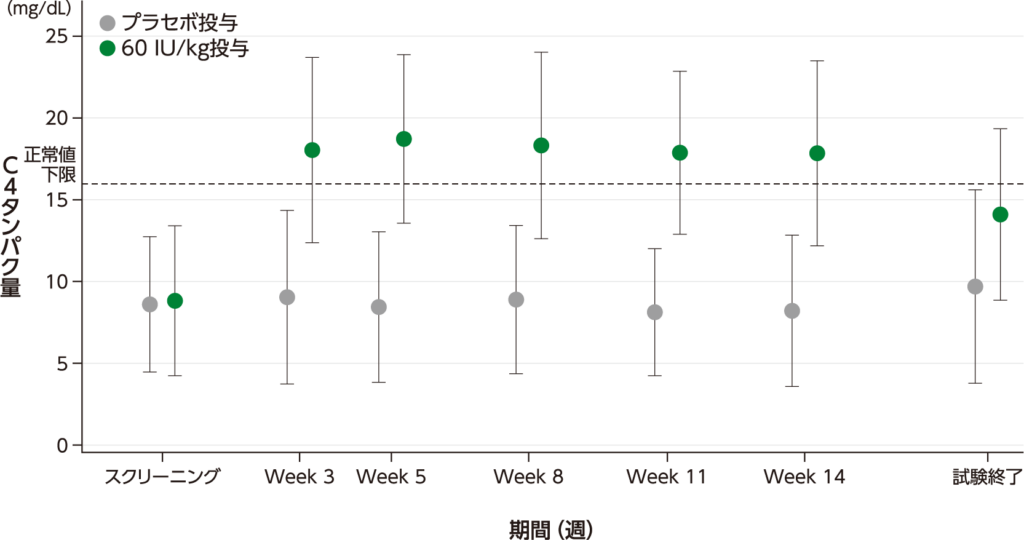
・40 IU/kg投与の結果は、承認外の用法及び用量のため削除した。
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。
安全性
有害事象は40 IU/kg投与で43例中29例(67.4%)、60 IU/kg投与で43例中30例(69.8%)、プラセボ投与で86例中57例(66.3%)に発現し、副作用は40 IU/kg投与で43例中14例(32.6%)、60 IU/kg投与で43例中15例(34.9%)、プラセボ投与で86例中22例(25.6%)に発現しました。
主な副作用は、40 IU/kg投与で注射部位紅斑及び注射部位疼痛が43例中各7例(16.3%)、注射部位浮腫が43例中5例(11.6%)、注射部位硬結及び注射部位出血が43例中各3例(7.0%)に発現し、60 IU/kg投与で注射部位紅斑が43例中8例(18.6%)、注射部位疼痛が43例中7例(16.3%)、注射部位硬結及び注射部位腫脹が43例中各4例(9.3%)に発現し、プラセボ投与で注射部位紅斑が86例中12例(14.0%)、注射部位疼痛が86例中9例(10.5%)、注射部位内出血が86例中5例(5.8%)、注射部位出血及び注射部位腫脹が86例中各4例(4.7%)に発現しました。
重篤な有害事象は、40 IU/kg投与で1例(尿路性敗血症)、プラセボ投与で2例(肺塞栓症1例、HAE及び失神1例)に認められました。試験中止に至った有害事象は、60 IU/kg投与で1例(蕁麻疹)、プラセボ投与で2例(肺塞栓症1例、肝酵素上昇1例)に認められました。死亡例は認められませんでした。
有害事象の概要(Safety Population)
| 40 IU/kg投与 (N=43) | 60 IU/kg投与 (N=43) | プラセボ投与※ (N=86) | |
|---|---|---|---|
| 有害事象 | 29(67.4%) | 30(69.8%) | 57(66.3%) |
| 副作用 | 14(32.6%) | 15(34.9%) | 22(25.6%) |
| 重篤な有害事象 | 1(2.3%) | 0 | 2(2.3%) |
| 試験中止に至った有害事象 | 0 | 1(2.3%) | 2(2.3%) |
| 死亡 | 0 | 0 | 0 |
※:プラセボが投与されたすべての被験者を含む
例数(%)
副作用(Safety Population)
| 40 IU/kg投与 (N=43) | 60 IU/kg投与 (N=43) | プラセボ投与※ (N=86) | |
|---|---|---|---|
| 副作用 | 14(32.6%) | 15(34.9%) | 22(25.6%) |
| 一般・全身障害および投与部位の状態 | 13(30.2%) | 13(30.2%) | 20(23.3%) |
| 注射部位紅斑 | 7(16.3%) | 8(18.6%) | 12(14.0%) |
| 注射部位疼痛 | 7(16.3%) | 7(16.3%) | 9(10.5%) |
| 注射部位浮腫 | 5(11.6%) | 0 | 3(3.5%) |
| 注射部位硬結 | 3(7.0%) | 4(9.3%) | 2(2.3%) |
| 注射部位出血 | 3(7.0%) | 1(2.3%) | 4(4.7%) |
| 注射部位内出血 | 2(4.7%) | 3(7.0%) | 5(5.8%) |
| 注射部位腫脹 | 1(2.3%) | 4(9.3%) | 4(4.7%) |
| 注射部位発疹 | 1(2.3%) | 2(4.7%) | 1(1.2%) |
| 注射部位そう痒感 | 1(2.3%) | 2(4.7%) | 1(1.2%) |
| 注射部位血腫 | 2(4.7%) | 0 | 1(1.2%) |
| 注射部位熱感 | 1(2.3%) | 1(2.3%) | 0 |
| 注射部位分泌物 | 0 | 1(2.3%) | 1(1.2%) |
| 無力症 | 1(2.3%) | 0 | 0 |
| 注射部位冷感 | 0 | 1(2.3%) | 0 |
| 注射部位反応 | 1(2.3%) | 0 | 0 |
| 注射部位蕁麻疹 | 1(2.3%) | 0 | 0 |
| 発熱 | 1(2.3%) | 0 | 0 |
| 疲労 | 0 | 0 | 1(1.2%) |
| 神経系障害 | 2(4.7%) | 0 | 1(1.2%) |
| 浮動性めまい | 2(4.7%) | 0 | 0 |
| 頭痛 | 0 | 0 | 1(1.2%) |
| 胃腸障害 | 1(2.3%) | 1(2.3%) | 0 |
| 腹痛 | 0 | 1(2.3%) | 0 |
| 悪心 | 1(2.3%) | 0 | 0 |
| 下痢 | 1(2.3%) | 0 | 0 |
| 皮膚および皮下組織障害 | 0 | 1(2.3%) | 0 |
| 蕁麻疹 | 0 | 1(2.3%) | 0 |
| 感染症および寄生虫症 | 0 | 1(2.3%) | 0 |
| 注射部位感染 | 0 | 1(2.3%) | 0 |
| 免疫系障害 | 1(2.3%) | 0 | 0 |
| カフェインアレルギー | 1(2.3%) | 0 | 0 |
| 筋骨格系および結合組織障害 | 1(2.3%) | 0 | 0 |
| 筋肉痛 | 1(2.3%) | 0 | 0 |
| 臨床検査 | 0 | 0 | 1(1.2%) |
| フィブリンDダイマー増加 | 0 | 0 | 1(1.2%) |
| 呼吸器、胸郭および縦隔障害 | 0 | 0 | 1(1.2%) |
| 肺塞栓症 | 0 | 0 | 1(1.2%) |
※:プラセボが投与されたすべての被験者を含む
例数(%) MedDRA version 18.0
6. 用法及び用量
本剤を添付の溶解液全量で溶解し、皮下投与する。通常、1回体重1kg当たり60国際単位を週2回投与する。