CSL23-178
― 医薬品の適正使用に欠かせない情報です。必ずお読みください。―
ハイゼントラ20%皮下注 電子化された添付文書改訂のお知らせ
この度、標記製品の電子化された添付文書を改訂いたしましたので、お知らせいたします。
今後のご使用に際しましては、本お知らせの内容をご参照くださいますようお願い申し上げます。
◇主な改訂内容
<改訂理由>
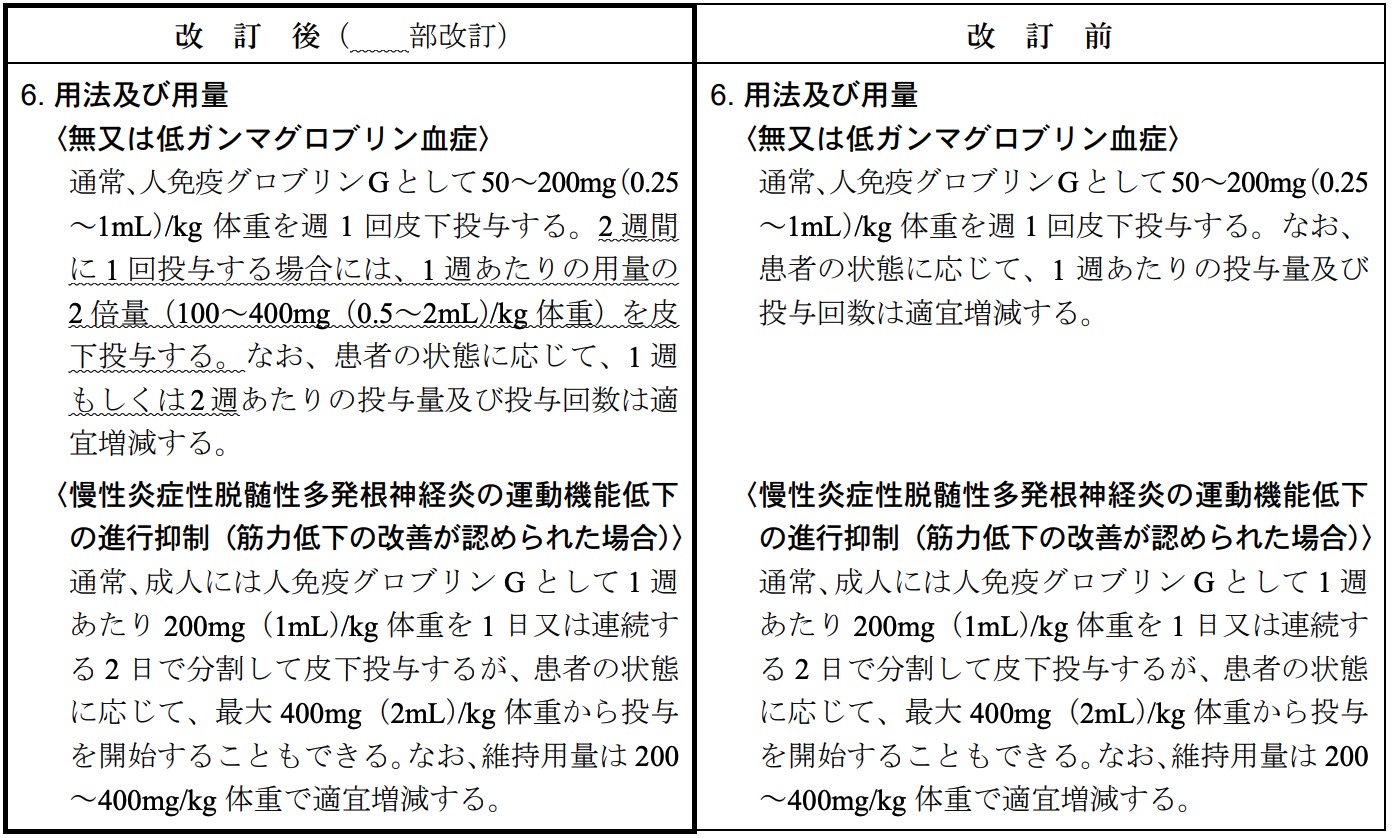
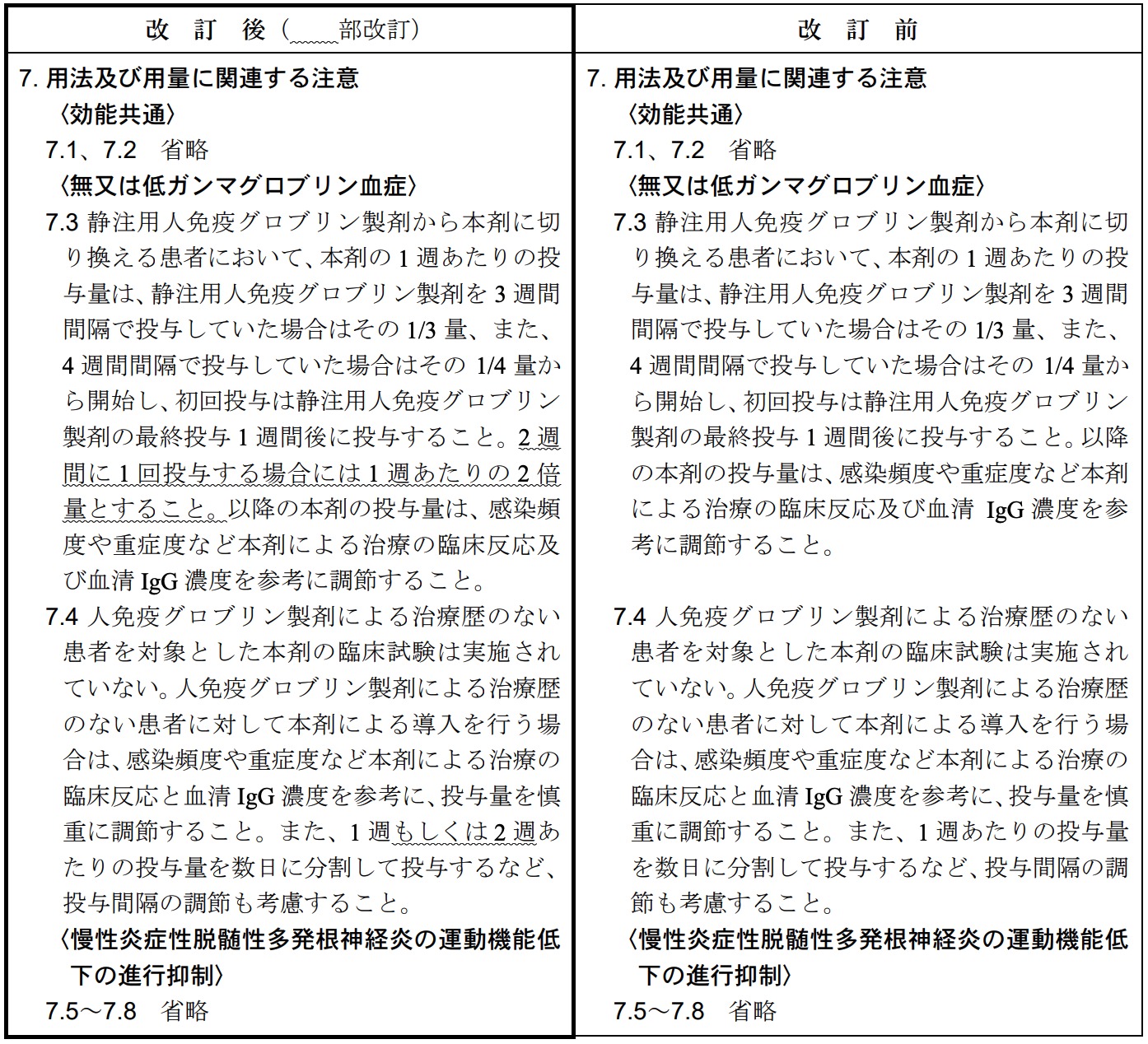
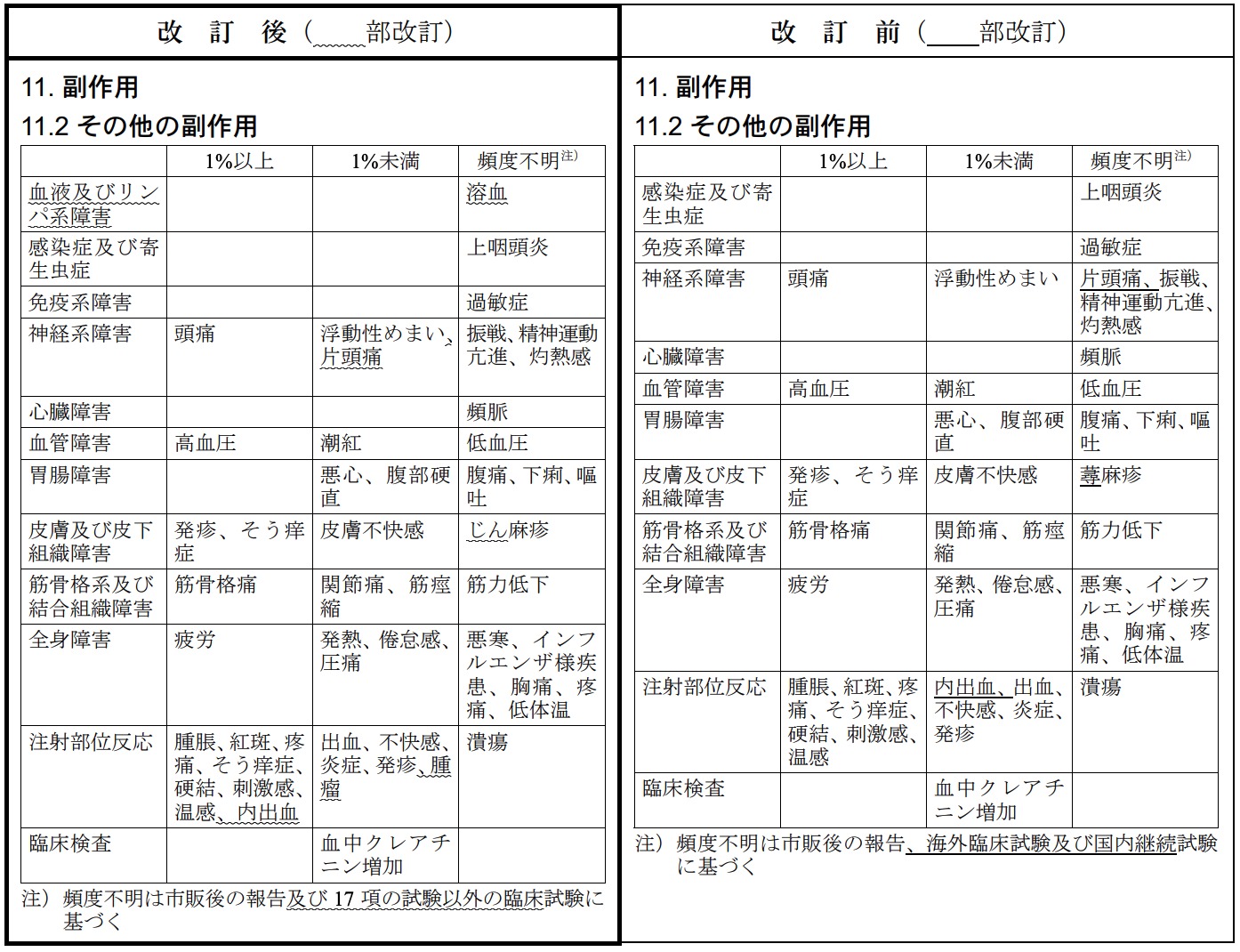
「無又は低ガンマグロブリン血症」の「用法及び用量」につきまして製造販売承認事項一部変更承認を取得いたしました。これに伴い、「6. 用法及び用量」、「7. 用法及び用量に関連する注意」及び「11. 副作用」を改訂いたしました。
また、「16. 薬物動態」、「17. 臨床成績」及び「23. 主要文献」の項の改訂を行っておりますので、電子化された添付文書をご参照いただきますようお願い申し上げます。
医薬品添付文書改訂情報は PMDA ホームページ「医薬品に関する情報」(https://www.pmda.go.jp/safety/info-services/drugs/0001.html)に最新の電子化された添付文書が掲載されます。あわせてご利用ください。
また、下記に記載の GS1 バーコードを添付文書閲覧アプリ「添文ナビ」で読み取ることにより、PMDA ホームページの電子化された添付文書を閲覧することが可能です。
ハイゼントラ 20%皮下注
