血液がん治療と免疫グロブリン
1. 低ガンマグロブリン血症の原因
低ガンマグロブリン血症は原発性と続発性に分けられる。原発性低ガンマグロブリン血症は、先天的に抗体産生や抗体の機能に障害があり、さまざまな遺伝性疾患に起因する1, 2)。続発性低ガンマグロブリン血症には疾患由来のものと薬剤由来のものがある。疾患由来では、慢性リンパ性白血病(CLL)、リンパ腫、多発性骨髄腫(MM)など血液がんによるものが多く、その他、腎臓(ネフローゼ症候群)、腸疾患(クローン病、潰瘍性大腸炎など)および皮膚欠損(重症熱傷、重症皮膚炎)による蛋白質の喪失によるものがある。薬剤由来では、従来の免疫抑制薬(シクロホスファミド、メトトレキサート、ミコフェノール酸モフェチル)、ステロイド、B細胞標的薬などに起因するものがあり、薬剤以外の医原性のものとして放射線治療、臓器移植2-5)、同種造血幹細胞移植6)などがある。
以下、続発性低ガンマグロブリン血症を中心に解説する。
2. 疾患由来と治療由来の低ガンマグロブリン血症
すでに述べたように、続発性低ガンマグロブリン血症には疾患由来のものと薬剤由来のものがあり、疾患由来ではCLL、MMなど血液がんがあげられる。低ガンマグロブリン血症はCLL患者の最大85%にみられ、その罹患率は疾患期間、進行期および感染頻度と関連している7)。MM患者でも低ガンマグロブリン血症が高頻度にみられ、くすぶり型MMではいずれかの時点で患者の45~83%に発症する8)。
これらの疾患における低ガンマグロブリン血症の発症機序は多岐にわたる。非クローン性CD5陰性B細胞の機能不全および形質細胞とCLL―B細胞間のCD95L/CD95相互作用を介したCD95陽性骨髄形質細胞の直接抑制がB細胞不全の原因と考えられている7)。形成された偽濾胞内でCLL-B細胞がヘルパーT細胞の機能を阻害することにより正常B細胞の機能が抑制され9)、さらにCLL-B細胞は骨髄形質細胞によるIgG産生も直接抑制する10)。
CLLおよびMMでは、疾患自体が低ガンマグロブリン血症を引き起こしうるが、治療も低ガンマグロブリン血症のリスクとなる。CLLおよびMMの治療は免疫能を抑制することが多く、治療薬の種類や投与量、あるいは罹患期間や病期により、臨床的に重大な感染症のリスクが高まる11)。
CLLおよびMM患者では、疾患自体および従来の化学療法による続発性低ガンマグロブリン血症のリスクに加えて、最近の治療の大きな進歩により医原性の続発性低ガンマグロブリン血症リスクが大幅に増大した2, 5)。リスク増大に関わる新たなB細胞標的薬を図1に示す12)。
これらの標的薬は、B細胞を枯渇(抗CD20抗体、抗CD52抗体、抗CD74抗体、抗CD19抗体、抗CD22抗体)、形質細胞を枯渇(抗CD38抗体)、あるいはB細胞の生存を阻害(抗B細胞活性化因子[BAFF]抗体)、活性化を阻害(プロテアソーム阻害薬、ブルトン型チロシンキナーゼ[BTK])阻害薬)、T細胞との相互作用を阻害(抗CD80/86抗体)することから2)、いずれも医原性の続発性低ガンマグロブリン血症の原因となる可能性がある。また、キメラ抗原受容体(CAR)-T細胞療法もB細胞除去を目標とする治療であることから同様の可能性がある13)。
このようなB細胞分化経路を標的とした新たなB細胞標的薬は急増しているが、これらの治療薬による続発性低ガンマグロブリン血症に関するエビデンスは限られている12)。抗CD20抗体治療による低ガンマグロブリン血症には、抗体薬投与だけではなく、抗体薬投与前のシクロホスファミド、ステロイド、プリン合成阻害薬などによる治療や併用療法、顆粒球コロニー刺激因子が関連すると報告されている14)。抗CD20抗体投与を受けた非ホジキンリンパ腫患者211例の研究では、抗CD20抗体投与前の血清IgG値は、179例(85%)が正常で32例(15%)が低値であった。抗CD20抗体投与により、投与前の血清IgG値正常患者の179例中69例(38.5%)で低ガンマグロブリン血症が発症し、投与前から低ガンマグロブリン血症がみられた患者の32例中23例(72%)で低ガンマグロブリン血症が悪化した15)。
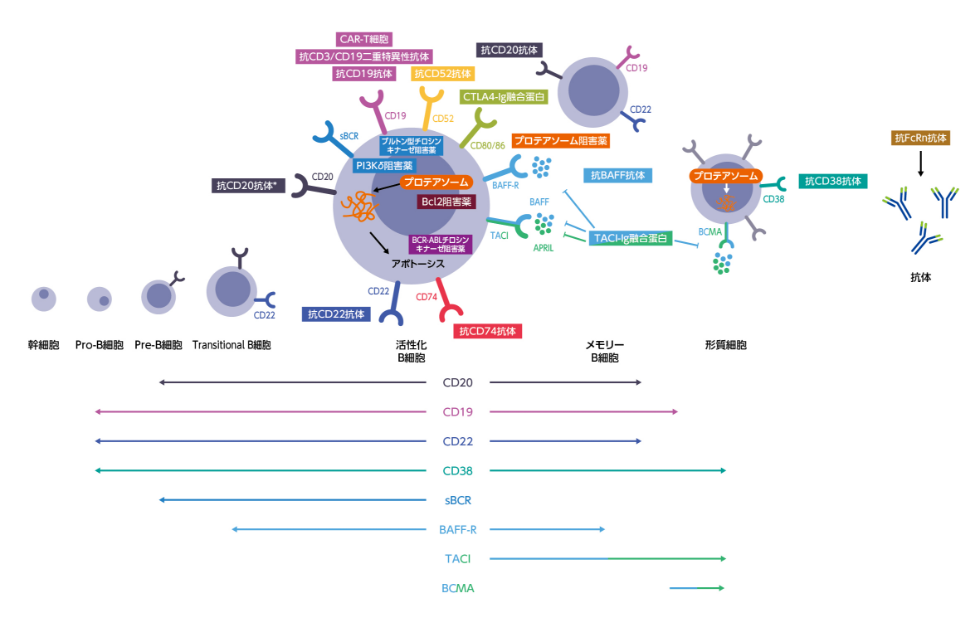
図1 続発性低ガンマグロブリン血症の原因となりうるB細胞特異的治療
*他の薬物を結合させた抗CD20抗体も開発されている。APRIL=a proliferation inducing ligand、BAFF(-R)=B-cell activating factor(receptor)、Bcl2=B cell lymphoma 2、BCMA=B-cell maturation antigen、(s)BCR=(surface) B cell receptor、TACI=transmembrane activator, and calcium modulator。
[Reproduced with the permission of the copyright holder, The Royal College of Physicians. Copyright © 2019 Patel, Carbone and Jolles. This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY).]
3. 低ガンマグロブリン血症で感染症に至る可能性がある
CLLにおける感染症の発症頻度は低ガンマグロブリン血症と関連があり、CLL患者の死因の25~50%が感染関連死である7)。MM患者3,107例を対象とした研究で、診断から60日以内の死亡の45%が感染によるものであった16)。MM患者では呼吸器感染症(肺炎、敗血症)が最も多く、尿路感染症もよくみられた5)。続発性低ガンマグロブリン血症を伴うMM患者46例の臨床試験では、MM患者の約75%で感染症を発症した。感染症の発現頻度は、病勢の安定期では活動期および治療中に比べて低かった(58% vs 87%)。進行期ではさらに増加し、ほぼ全例に感染症が発症し、そのうち約40%は重篤であった。主な感染部位は呼吸器系であり、約70%を占めていた17)(図2)。
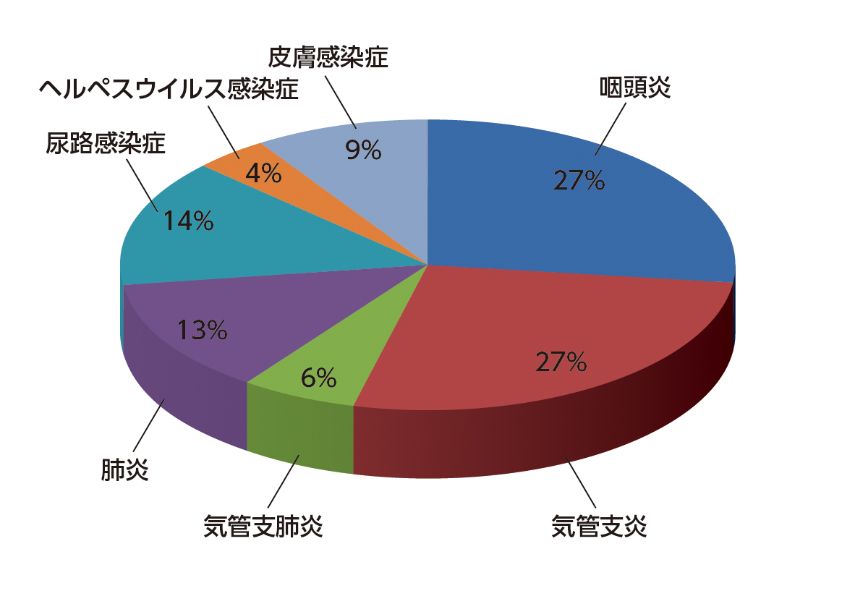
図2 多発性骨髄腫患者における感染症発症率
感染症はMM患者の約75%で診断され、特に活動期と治療中(87%)に高頻度に発症した。そのうち約40%は重症/重篤であった。
[Reprinted from Clinical Immunology , 191, Vacca A, et al. Subcutaneous immunoglobulins in patients with multiple myeloma and secondary hypogammaglobulinemia: a randomized trial,110-115, 2018, with permission from Elsevier.]
MM患者9,253例を対象とした大規模研究で、MM患者で感染症リスクは性別・年齢などを一致させた一般集団と比べて7倍高く、肺炎、敗血症および髄膜炎の発症リスクは、それぞれ7.7倍、15.6倍、および16.6倍であった。さらに、診断時期が2000~2004年の患者は1988~1993年の患者と比べて感染症リスクが2.8倍高いことが示され、その理由として、高用量メルファラン自家造血幹細胞移植と新薬導入の関与が挙げられている18)(表1)。前述の抗CD20抗体投与を受けた非ホジキンリンパ腫患者211例の研究で確認された非好中球減少性感染症は、気道感染症および上気道感染症が多かった15)。
表1 MM患者の感染症リスク(診断時期別の対照との比較、および1988~1993年との比較)
| 1988~1993年 n=3247 | 1994~1999年 n=3259 | 2000~2004年 n=2747 | |
| HR* | 5.7 | 7.0 | 8.9 |
| (95%CI) | (5.2~6.1) | (6.6~7.5) | (8.3~9.7) |
| HR** | 1.0 | 2.1 | 2.8 |
| (95%CI) | (Reference) | (1.9~2.4) | (2.5~3.2) |
| 診断時65歳超 | |||
| HR** | 1.0 | 2.0 | 2.6 |
| (95%CI) | (Reference) | (1.8~2.3) | (2.3~3.0) |
*対照者と比較した全患者の感染症リスク。
** 1988~1993年に診断された患者と比較した各期間に診断された患者の感染症リスク。
*** 診断時65歳超の患者について、1988~1993年に診断された患者と比較した各期間に診断された患者の感染症リスク。
[Reproduced with kind permission from haematologica: 2015, 100(1), Bilmark C, et al. ©2021 Ferrata Storti Foundation Material published in Haematologica is covered by copyright. All rights are reserved to the Ferrata Storti Foundation. Use of published material is allowed under the following terms and conditions: https://creativecommons.org/licenses/by-nc/4.0/legalcode. Copies of published material are allowed for personal or internal use. Sharing published material for non-commercial purposes is subject to the following conditions:
https://creativecommons.org/licenses/by-nc/4.0/legalcode, sect. 3. Reproducing and sharing published material for commercial purposes is not allowed without permission in writing from the publisher.]
4. 低ガンマグロブリン血症の治療
抗体産生不全を呈する原発性免疫不全症患者では、多くの場合、免疫グロブリン補充療法が必要である。原発性免疫不全症における肺炎の発症頻度に対するIgGトラフ値の影響に関する臨床試験のメタ解析では、解析に含めた全ての試験で、肺炎の発症頻度はIgGトラフ値の増加にともなって低下し、IgGトラフ値100 mg/dL増加する毎に肺炎の発症頻度が27%減少することが示唆された(IgGトラフ値100 mg/dL増加あたりの発症頻度比[IRR] 0.726)。IgGトラフ値500 mg/dLを維持した場合の肺炎の発症頻度は、1000 mg/dLを維持した場合の5倍であった(図3)。また、免疫グロブリン(静注)投与量が100 mg/kg増加する毎に肺炎の発症頻度が有意に低下した(IRR 0.726)19)。
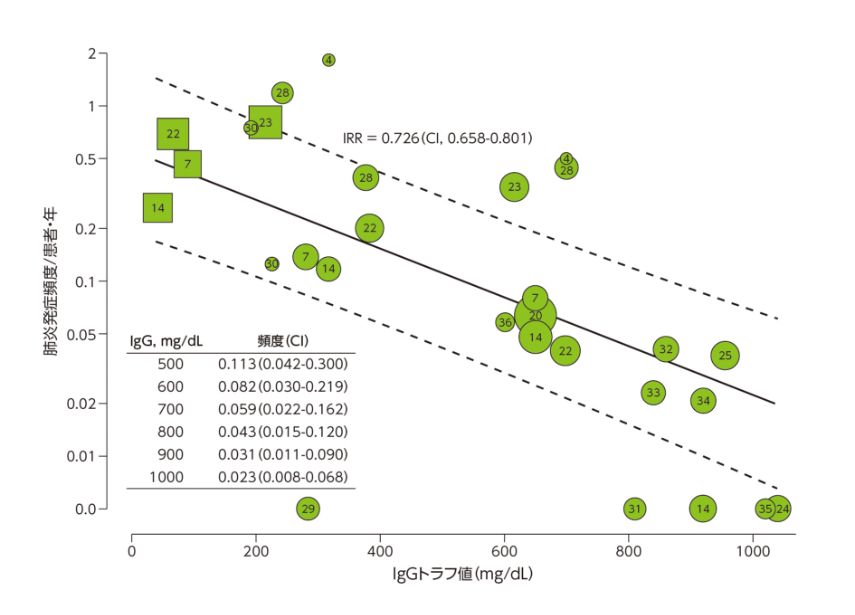
図3 肺炎発症頻度/患者・年に対するIgGトラフ値(mg/dL)の影響
各データポイントは1研究の1患者群の1観察期間のデータを示す。■および●はそれぞれ免疫グロブリン補充療法開始前後のデータであり、中に引用論文の番号を表示し、観察患者・年のlog値の割合に基づいて■および●の大きさを変えた。CI=95%信頼区間、IRR=IgGトラフ値100 mg/dL増加あたりの発症頻度比。
[Reprinted from Clinical Immunology , 137, Orange J.S. et al., Impact of trough IgG on pneumonia incidence in primary immunodeficiency: A meta-analysis of clinical studies,21-30., 2010, with permission from Elsevier.]
原発性低ガンマグロブリン血症に対する皮下投与による免疫グロブリン補充療法の有用性を検討した13の臨床試験の統合解析の結果、全感染症の年間発症頻度には血清IgG値と負の相関がみられたが統計学的に有意ではなかった(ピアソンの積率相関係数[r]=-0.438、p=0.178[分散分析]、解析可能な11試験で算出)。しかし、レトロスペクティブ試験の1試験を除外し、プロスペクティブ試験のみで解析すると、感染症の年間発症頻度と血清IgG値の間に有意な相関がみられ(r=-0.682、p=0.030[同上])、血清IgG値が100 mg/dL増加する毎に感染症の年間発症頻度が0.38イベント/患者/年減少した20)。
続発性低ガンマグロブリン血症では治療の1つとして、その原因を取り除くことが考えられるが、血液がんの場合、血液がん自体が原因の1つであり、また血液がん治療の中断は難しい。そこで、支持療法としてワクチン接種、抗菌薬投与や免疫グロブリン補充療法の施行が考慮される12)。
抗菌薬を予防的投与しているにもかかわらず重篤な感染症の再発を繰り返し、ワクチン接種も有効性を示さない免疫グロブリン低値(IgG<400 mg/dL)の患者に免疫グロブリン補充療法が有用な可能性があり、多くの研究において、CLL患者で免疫グロブリン補充療法(静注)により感染症の発症頻度が低下したことが示されている12)(表2)。
表2 CLLに対する免疫グロブリン補充療法のエビデンスのまとめ
| 引用論文 | 患者数 | 進行期*の 患者数 | 試験タイプ | IVIGの 用量/投与期間 | 試験期間 (月) | IVIG投与期間中の 感染症発症率 |
| Cooperativegroup (206) | 81 | 32 (39.5%) | 対照、ランダム化、 二重盲検 | 400 mg/kg/ 21日 | 12 | 減少 |
| Jurlander etal. (207) | 15 | 8 (53.3%) | 非対照、パイロット | 10 g/ 28日 | 12(平均) | 減少 |
| Chapel etal. (208) | 34 | 15 (44.1%) | 対照、ランダム化、 二重盲検 | 250 mg/kg vs. 500 mg/kg/ 28日 | 12 | 減少 |
| Sklenar etal. (209) | 31 | 2 (6.4%) | 用量設定 | 100~800 mg/kg/ 21日 | 4.5 | 減少 |
| Griffiths etal. (210) | 10 | 3 (30%) | 対照、ランダム化、 二重盲検 | 400 mg/kg/ 21日 | 12 | 減少 |
| Broughton etal. (211) | 42 | 15 (35.7%) | ランダム化 | 18 g/ 21日 | 12 | 減少 |
| Molica et al.(212) | 30 | 25 (83.3%) | ランダム化 クロスオーバー | 300 mg/kg/ 28日 | 6または12 | 減少 |
* Binet分類のC期またはRai分類のⅢ~Ⅳ期、IVIG=免疫グロブリン(静注)。
表中の引用論文番号()は、原著12)の引用論文リスト上の番号を示す。
[© The Authors 2019. Patel, Carbone and Jolles. Fromtiers in Immunology. Volume 10, Article 33, February 2019. This article is published with open access at https://doi.org/10.3389/fimmu.2019.00033. Creative Commons Attribution 4.0 International License.]
ハイゼントラの6.用法及び用量(抜粋)
〈無又は低ガンマグロブリン血症〉
通常、人免疫グロブリンGとして50~200mg(0.25~1mL)/kg体重を週1回皮下投与する。2週間に1回投与する場合には、1週あたりの用量の2倍量(100~400mg(0.5~2mL)/kg体重)を皮下投与する。なお、患者の状態に応じて、1週もしくは2週あたりの投与量及び投与回数は適宜増減する。
ピリヴィジェンの6.用法及び用量(抜粋)
〈無又は低ガンマグロブリン血症〉
通常、1回人免疫グロブリンGとして200~600 mg(2~6 mL)/kg体重を3~4週間隔で点滴静注又は緩徐に静注する。患者の状態によって適宜増減する。
また、前述した抗CD20抗体投与を受けた非ホジキンリンパ腫患者211例の研究では、低ガンマグロブリン血症に対して静注による免疫グロブリン補充療法を実施した14例について、免疫グロブリン補充療法前後6ヵ月間の非好中球減少性感染症の再発を比較した。その結果、免疫グロブリン補充療法前後の感染症発症回数中央値はそれぞれ2回および1回(範囲1~4、0~3)と、有意差が認められた(p=0.004[Fisherの正確確率検定、両側検定]、95%CI 0.211~1.45)。著者らは、免疫グロブリン補充療法で免疫グロブリン値が正常値になるには3~6ヵ月を要するため、同療法によりさらに大きなベネフィットが得られる可能性があると考察している15)。抗CD20抗体投与を受けた患者4,479例(がん患者3,478例[77.7%])の解析では、抗CD20抗体投与後に免疫グロブリン補充療法を施行した患者201例(4.5%)において、免疫グロブリンの累積投与量が高いほど重篤な感染症のリスクが低減することが示された(Cox回帰モデル:HR 0.98、95%CI 0.96~0.99、p=0.002)21)。
さらに、前述の続発性低ガンマグロブリン血症を伴うMM患者46例の臨床試験では、免疫グロブリン皮下投与を受ける群(SCIg群)と受けない群(対照群)にランダム化して有効性を検討した結果、SCIg群では対照群に比べて重症感染症および軽症~中等症の年間発症頻度(主要評価項目)、上気道および下気道感染症の年間発症頻度、重症感染症による平均年間入院日数および平均年間抗菌薬投与日数がいずれも低下した(図4)17)。
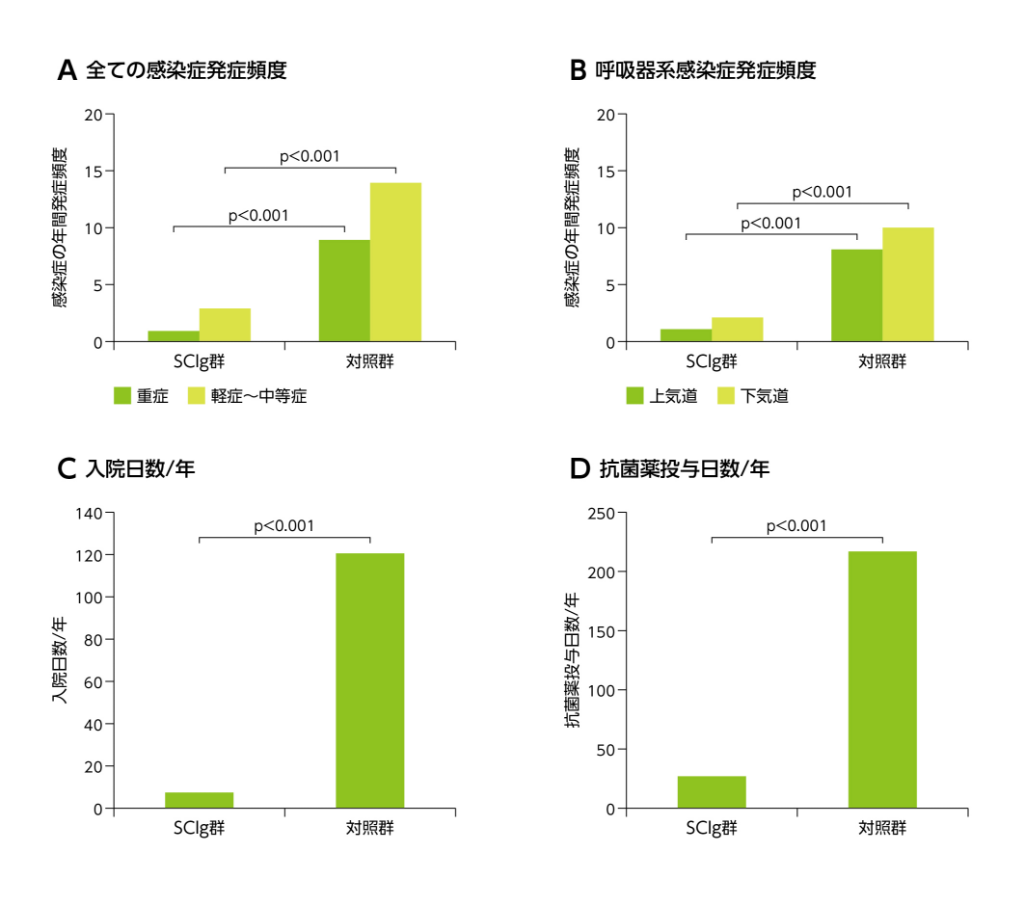
図4 MM患者における感染症
有意差検定は、Student-Fisherのt検定あるいはχ2検定を用いた。
[Reprinted from Clinical Immunology, 191, Vacca A, et al. Subcutaneous immunoglobulins in patients with multiple myeloma and secondary hypogammaglobulinemia: a randomized trial, 110-115, 2018, with permission from Elsevier.]
日本造血細胞移植学会のガイドライン22)では、免疫グロブリン補充療法に関して下記のように記載されている。
免疫グロブリンの予防的投与
- 造血幹細胞移植後の早期に細菌感染症やウイルス感染症を予防する目的で免疫グロブリンを投与することの有用性は確立していないため、全ての移植患者に免疫グロブリンの予防的投与を行うことは推奨しない。
- 移植前に高度の低免疫グロブリン血症(IgG<400 mg/dL)を認める場合や、移植後の免疫グロブリンの回復が遅延する場合には、免疫グロブリンの補充療法を考慮してもよい。
- 免疫グロブリンの補充療法を行う場合には、血清IgG濃度400~500 mg/dLを維持することを目標とする。移植後の患者血中における半減期が通常よりも短い(1~10日程度)とされていること、移植後早期に比較的大量の免疫グロブリンを投与することが肝中心静脈閉塞症のリスクの増加に関与することを示唆する報告等を考慮し、移植後7日目以降、1~2週間毎に血清IgG濃度を測定し、それに基づいて投与法を調整することを推奨する。
免疫グロブリンの治療的投与
造血幹細胞移植後の発熱性好中球減少症や細菌感染症の治療を目的として免疫グロブリンの補充療法を行うことは、高度の低免疫グロブリン血症(IgG<400 mg/dL)を認める場合などを除いて推奨しない。
欧州、英国、オーストラリア、カナダなど海外のガイドラインにおいても、血液がんやその治療による続発性低ガンマグロブリン血症に対する治療として免疫グロブリン補充療法が推奨されている23-27)。
引用論文
- Picard C, et al. J Clin Immunol. 2015; 35: 696-726.
- Srivastava S, et al. Clin Med. 2016; 16: 571-576.
- Chinen J, et al. J Allergy Clin Immunol. 2010; 125(2 Suppl. 2): S195-203.
- Jolles S, et al. Clin Exp Immunol. 2017; 188: 333-341.
- Friman V, et al. Hematol Oncol. 2016; 34: 121-132.
- Frangoul H, et al. Bone Marrow Transplant. 2013; 48: 1456-1459.
- Dhalla F, et al. J Clin Immunol. 2014; 34: 277-282.
- Seppänen M. Clin Exp Immunol. 2014; 178(Suppl. 1): 10-13.
- Hamblin AD, et al. Br Med Bull. 2008; 87: 49-62.
- Sampalo A, et al. Blood. 2000; 96: 3168-3174.
- Dhalla F, et al. Curr Opin Allergy Clin Immunol. 2015; 15: 505-513.
- Patel SY, et al. Front Immunol, 2019; 10: 33.
- Maus MV, et al. Blood. 2014; 123: 2625-2635.
- Christou EAA, et al. Int Rev Immunol. 2017; 36: 352-359.
- Casulo C, et. al. Clin Lymphoma Myeloma Leuk. 2013; 13: 106-111.
- Augustson BM, et al. J Clin Oncol. 2005; 23: 9219-9226.
- Vacca A, et al. Clinical Immunol. 2018; 191: 110-115.
- Blimark C, et al. Haematologica. 2015; 100: 107-113.
- Orange JS, et al. Clin Immunol. 2010; 137: 21-30.
- Orange JS, et al. Clin Exp Immunol. 2012; 169: 172-181.
- Barmettler S, et al. JAMA Netw Open. 2018;1: e184169.
- 造血細胞移植ガイドライン 造血細胞移植後の感染管理(第4版)2017年9月 日本造血細胞移植学会発行
- European Medicines Agency. Guideline on Core SmPC for Human Normal Immunoglobulin for Intravenous Administration (IVIg): EMA (2020).
https://www.ema.europa.eu/en/documents/scientific-guideline/draft-guideline-core-smpc-human-normal-immunoglobulin-intravenous-administration-ivig-rev-6_en.pdf(2021/5/18参照) - Department of Health. Clinical Guidelines for Immunoglobulin Use (2011).
https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/216671/dh_131107.pdf(2021/5/18参照) - Australian National Blood Authority. Acquired Hypogammaglobulinaemia Secondary to Haematological Malignancies, or Post-Haemopoietic Stem Cell Transplantation (HSCT): BloodStar (2018).
https://www.criteria.blood.gov.au/MedicalCondition/View/2570(2021/5/18参照) - Australian National Blood Authority. Secondary Hypogammaglobulinaemia Unrelated to Haematological Malignancy or Haemopoeitic Stem Cell Transplant (HSCT): BloodStar (2018).
https://www.criteria.blood.gov.au/MedicalCondition/View/2577(2021/5/18参照) - Alberta Ministry of Health, Shared Health Manitoba, Saskatchewan Ministry of Health. Criteria for the Clinical Use of Immune Globulin (2018).
https://www.ihe.ca/download/criteria_for_the_clinical_use_of_immune_globulin_first_edition.pdf(2021/5/20参照)