開発の経緯
HAEの根治療法は現時点ではなく、臨床症状は依然として生命を脅かす可能性のある発作を伴い重篤である。HAE急性発作の発症抑制又は治療として現在利用可能な治療法には、C1-INH製剤、カリクレイン阻害薬及びブラジキニン受容体拮抗薬の静脈内投与、皮下投与又は経口投与がある。
これらの治療の進歩にもかかわらず、ブレイクスルー発作が頻繁に発現し、疾患の活動性が高く、一部の患者では依然として生命を脅かす喉頭発作を発現する可能性が高い。喉頭発作は、約50%のC1-INHHAE患者で生涯のうちに発現すると推定されることから、依然として患者の疾病負荷及びQoLに対処するアンメット・メディカル・ニーズが存在する1)。発作の発現に伴う不確実性は不安や恐怖を生み出し、HAE患者のQoLに大きな影響を与える。HAE発作の発現は予測不能であり、全体的な疾患重症度はHAE患者間で大きく異なるため、発作を取り除く又はHAE発作の頻度及び重症度を確実に軽減する有効な治療に対するアンメット・メディカル・ニーズは依然として存在する。さらに、静脈へのアクセス、頻回投与の必要性及び忍容性の問題に関連する治療負荷は、これらの治療計画に対する患者のコンプライアンス、ひいてはHAE患者の医学的転帰に負の影響を及ぼす可能性がある2)。このような状況を踏まえ、HAE患者における上述のアンメット・メディカル・ニーズに対処するため、ガラダシマブ(アナエブリ)の開発を計画した。開発では意味のある臨床的有効性指標、良好な安全性及び忍容性プロファイル、並びに患者のコンプライアンスの促進、治療負荷の軽減及び投与利便性の向上に寄与できる重要な要素である投与量、製品仕様及び用法及び用量に焦点を当てた。
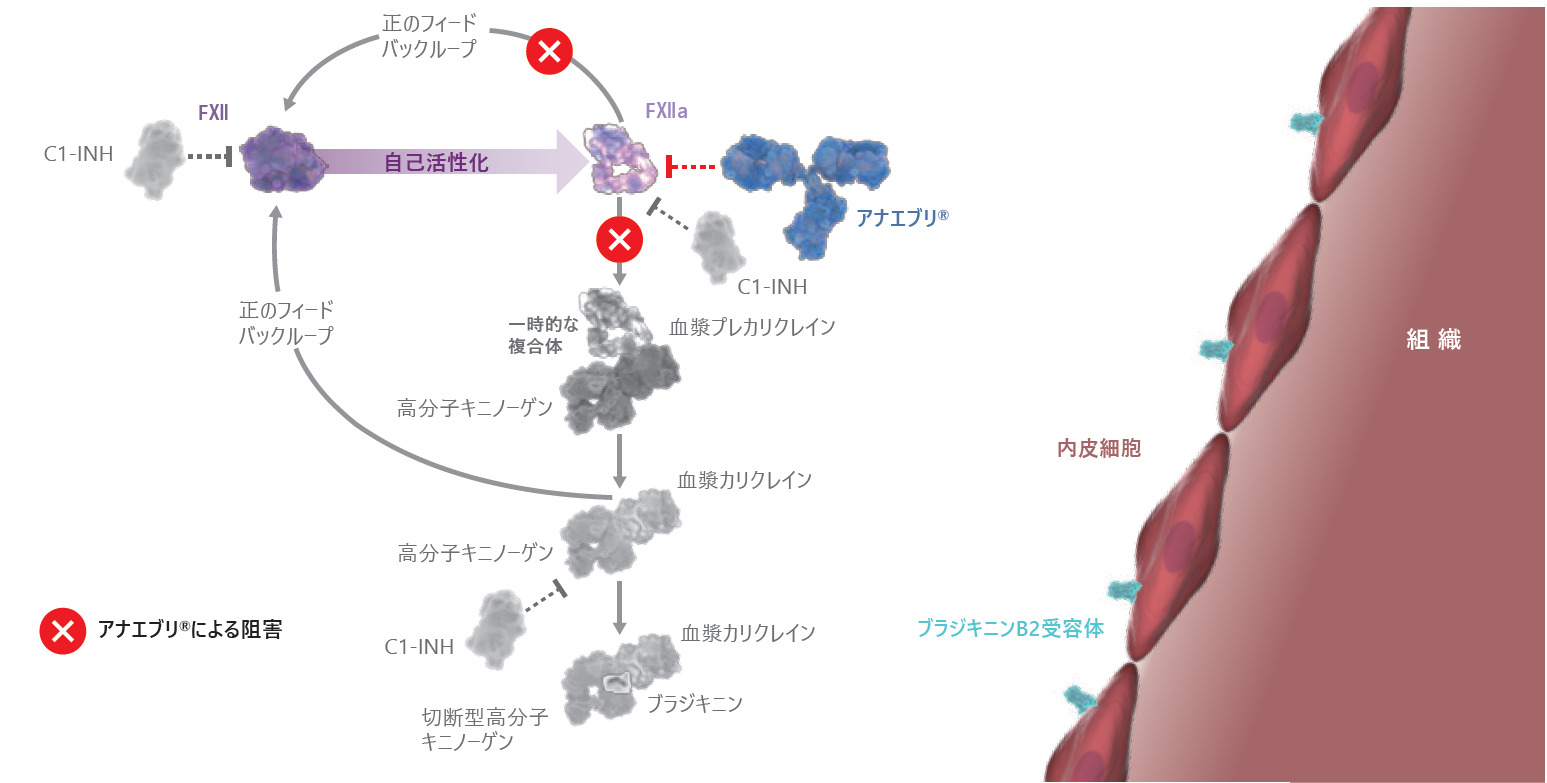
アナエブリは新規の遺伝子組換えヒト型IgG4/λモノクローナル抗体であり、活性型血液凝固第Ⅻ因子(FⅫa)の触媒ドメインに結合し、その触媒活性を阻害する。アナエブリはチャイニーズハムスター卵巣細胞で発現し、ジスルフィド結合で架橋された重鎖2本と軽鎖2本からなる、IgG4モノクローナル抗体に典型的な構造を有する。またアナエブリは、接触系の主要開始因子であるFⅫa阻害を介しプレカリクレインのカリクレインへの活性化及びブラジキニン産生を抑制する。
アナエブリは初回投与開始後からHAE急性発作の発症を抑制し、多くの患者で試験終了時点まで発作の発症が抑制できていた。また、月1回の簡便な皮下投与であることから、HAE発作の発症抑制療法を進歩させている。したがって、HAE発作の発症抑制において、アナエブリはHAE患者におけるアンメット・メディカル・ニーズを充たすことが期待される。
ピボタル試験である国際共同第Ⅲ相試験:VANGUARD試験(3001試験)の成績から、成人患者及び青少年患者(12歳以上)におけるHAE発作の発症抑制に対するアナエブリの有用性が示された。そのため、2024年2月に製造販売申請を行い、2025年2月に「遺伝性血管性浮腫の急性発作の発症抑制」に対する製造販売承認を取得した。
特徴(特性)
- 本剤は新規のヒト抗活性化第Ⅻ因子モノクローナル抗体であり、活性型血液凝固第Ⅻ因子(FⅫa)の触媒ドメインに結合し、その触媒活性を阻害する。
- 本剤は月1回皮下投与のオートインジェクター製剤である。
- HAE患者(日本人患者を含む)を対象とした国際共同第Ⅲ相試験:VANGUARD試験(3001試験)において、治療期6ヵ月間の月間HAE発作回数の平均値は、プラセボ群2.01回/月、アナエブリ群0.27回/月であり、統計的に有意差が認められた(検証的解析結果:p<0.001、両側Wilcoxon検定)。また、治療期6ヵ月間の月間HAE発作回数の中央値はプラセボ群1.35回/月、アナエブリ群0.00回/月であった。
- HAE患者(日本人患者を含む)を対象とした国際共同第Ⅲ相試験:VANGUARD試験(3001試験)において、治療期6ヵ月間の要時治療(急性期治療)を要した月間HAE発作回数の平均値は、プラセボ群で1.86回/月、アナエブリ群で0.23回/月であり(名目上のp値:p<0.001、両側Wilcoxon検定)、中央値はプラセボ群で1.35回/月、アナエブリ群で0.00回/月であった。
- HAE患者(日本人患者を含む)を対象とした国際共同第Ⅲ相試験:VANGUARD試験(3001試験)において、本剤の効果は初回投与から早期に発現し、治療期前半3ヵ月間に認められ、6ヵ月間の治療期の残りの期間にわたって概して持続した。
- HAE患者(日本人患者を含む)を対象とした国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)において、アナエブリ群の観察期に対する治療期の月間HAE発作回数の減少率の平均値は94.67%、中央値は100%であった。
- 重大な副作用として、重篤な過敏症(頻度不明)があらわれることがある。
HAE患者(日本人患者を含む)を対象とした国際共同第Ⅲ相試験:VANGUARD試験(3001試験)において、主な副作用として5.1%に注射部位反応(内出血、紅斑、そう痒感)が認められた。詳細は、電子添文の副作用の項及び臨床成績の項の安全性の結果を参照。
国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)、海外第Ⅱ相試験(2001試験)の安全性の結果を参照。
アナエブリ皮下注の作用機序13-17)
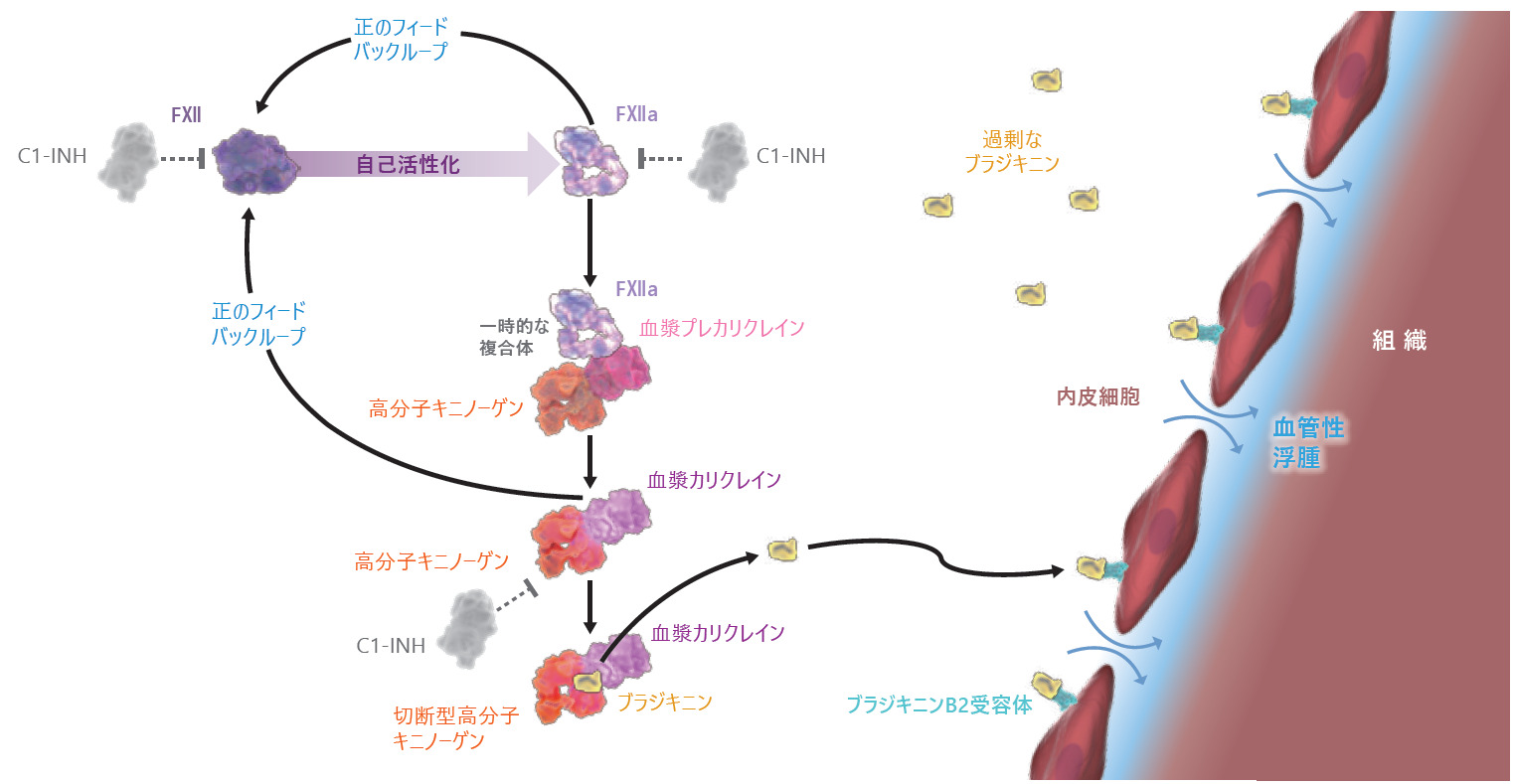
アナエブリは活性型血液凝固第Ⅻ因子(FⅫa)の触媒ドメインに結合し、その触媒活性を阻害する。第Ⅻ因子は接触活性化経路で最初に活性化される因子であり、炎症性ブラジキニン産生カリクレイン-キニン系を開始する。本剤はプレカリクレインからカリクレインへの活性化を抑制し、それに続く遺伝性血管性浮腫の発作における炎症及び腫脹に関連するブラジキニンの生成を抑制する。
■HAE発作の発生機序
■アナエブリの作用機序
非臨床試験18)
❶ バイオセンサーデータ:ガラダシマブのFⅫ及びβFⅫaへの結合(in vitro )
SPR(表面プラズモン共鳴)バイオセンサー解析により、ガラダシマブ及び親抗体である3F7の複数動物種のFⅫ及びβFⅫaへの結合に関する反応速度定数(会合速度[Ka]、解離速度[kd]、平衡解離定数[KD])及び親和性を測定した。
親抗体である3F7は、ヒトβFⅫa(KD=3nM)に対する結合親和性が、ヒトザイモーゲンFⅫ(KD=56nM)に対する結合親和性と比較して20倍程度高いことがわかる。ガラダシマブは、3F7親抗体と比較して、ヒトザイモーゲンFⅫ(55nM)に対する親和性を維持し、ヒトβFⅫa(KD=0.14nM)に対する親和性は約20倍強かった。
さらに、in vivo 薬理試験を裏付けるために、マウス及びウサギのFⅫタンパク質に対するガラダシマブ及び3F7の結合親和性を検討した。マウス及びウサギのβFⅫaに対するガラダシマブの親和性はそれぞれ0.7及び0.4nMであった。
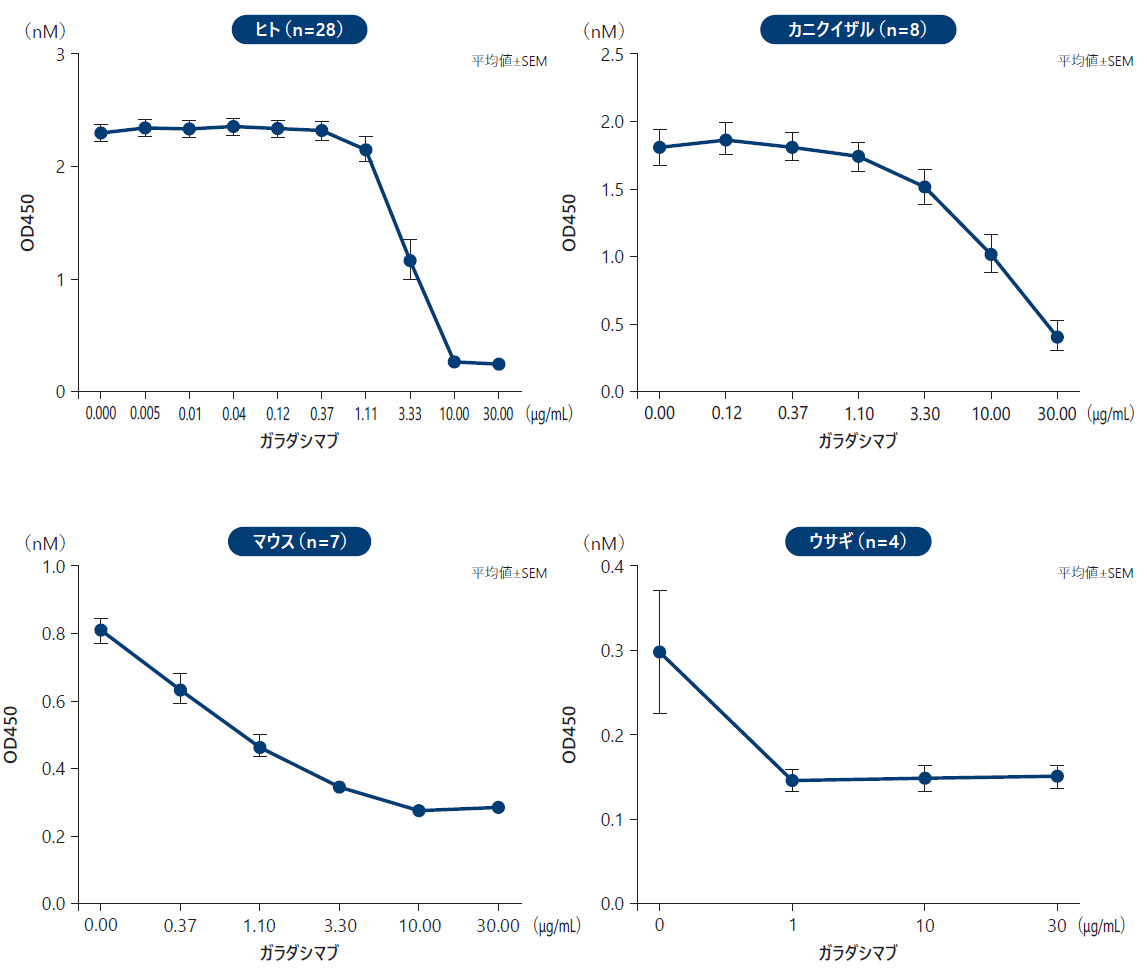
❷ 非ヒト動物種におけるFⅫ活性とガラダシマブによる阻害作用(in vitro )
FⅫ活性は、非ヒト動物種(カニクイザル、マウス、ウサギ)を用いて分析し、ヒトと比較した。すべての動物種の血漿サンプルを、漸増量のガラダシマブとインキュベートし、その後DXSで刺激した。ガラダシマブによるFⅫa活性の阻害は、発色性合成基質法で測定した。
試験したすべての動物種において、ガラダシマブは用量依存的にFⅫaを阻害することが示された。
■ガラダシマブの各種活性化血漿中FⅫa発色性活性の抑制作用
❸ ガラダシマブのヒトFⅫに対する特異性(in vitro )
ヒトFⅫに対するガラダシマブの特異性を明らかにするため、構造的に関連するヒトセリンプロテアーゼのパネル(活性化血液凝固Ⅶ因子、活性化血液凝固Ⅸ因子、活性化血液凝固Ⅹ因子、活性化血液凝固Ⅺ因子、カリクレイン、組織プラスミノーゲンアクチベーター、活性化プロテインC、ウロキナーゼ型プラスミノーゲンアクチベーター、プラスミン)の触媒活性に対する阻害能を精製酵素を用いてin vitro で検討した。
ガラダシマブは強力なFⅫ阻害薬であり、酵素:抗体の比率を1:0.5でインキュベートすると、触媒活性(FⅫa及びβFⅫa)を100%阻害した。
一方、構造的に関連するセリンプロテアーゼの阻害作用について、酵素と抗体の比率を1:500まで上げて試験したところ、どのプロテアーゼについても、試験したガラダシマブの最高濃度においても50%阻害濃度(IC50)に達しなかった。
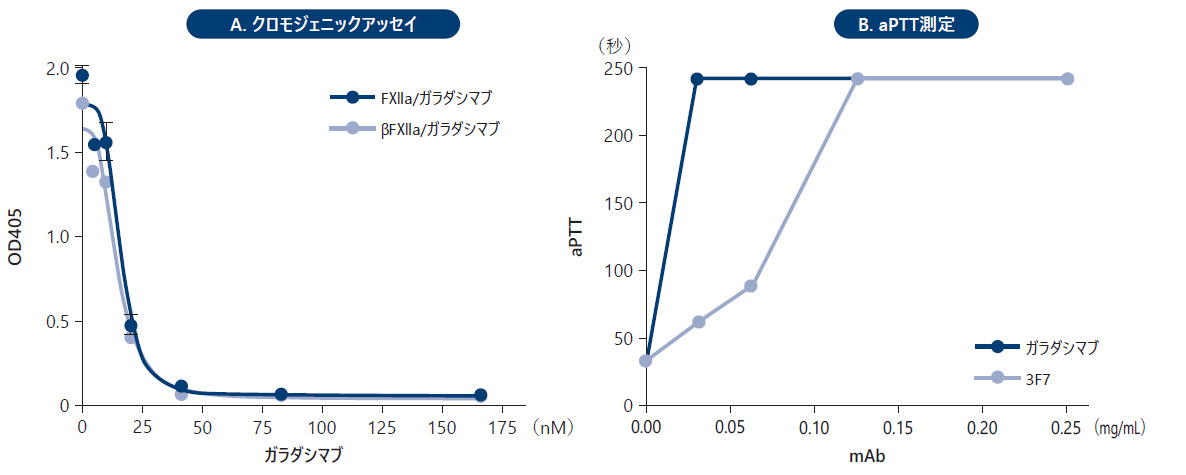
❹ FⅫaアミド分解活性及びaPTT測定(in vitro )
ガラダシマブの阻害作用は、精製したヒトFⅫa及びβFⅫaを用いたin vitro 発色性合成基質法、及び接触を介したFⅫ活性化後の内因性凝固経路の活性を測定する活性化部分トロンボプラスチン時間(aPTT)検査により検討した。また、aPTT測定において、ガラダシマブの効力を親抗体の3F7と比較した。
ガラダシマブは、ヒトFⅫaとβFⅫaの両方のアミド分解活性に対して阻害作用を示した(図A)。62.5nMのFⅫa存在下でガラダシマブはFⅫa活性を阻害し、そのIC50値は15nMであった。ガラダシマブと親抗体の3F7のいずれもaPTT凝固時間を最大値(240秒)まで延長したが、ガラダシマブは、3F7と比較してaPTT延長作用が約4倍であった(図B)。
■抗FⅫa抗体のin vitro 効力試験
薬物動態
【血中濃度12)】
❶ 単回投与(日本人健康成人)
日本人健康成人(12例)に本剤200mgを単回皮下投与したときの薬物動態パラメータは以下の通りであった。
■日本人健康成人(12例)における本剤200mg単回皮下投与時のガラダシマブの薬物動態パラメータ
| Tmax (h) | Cmax (μg/mL) | AUC0-last (μg·h/mL) | AUC0-inf (μg·h/mL) | CL/F (L/h) | VZ/F (L) | t1/2 (h) |
|---|---|---|---|---|---|---|
| 169 (8.00,171) | 21.2 (17.0) | 11,300 (5,510) | 11,900 (5,840) | 0.022 (0.014) | 12.5 (5.84) | 424 (72.2) |
Tmax:最高血漿中濃度到達時間、Cmax:最高血漿中濃度、AUC0-last:0時間から最終定量可能時間までの血漿中濃度-時間曲線下面積、AUC0-inf:0時間から無限時間まで外挿した血漿中濃度-時間曲線下面積、CL/F=見かけの全身クリアランス、Vz/F=消失相における見かけの分布容積
注)Tmaxは中央値(最小値、最大値)を示す。その他各パラメータは平均値(SD)を示す。
❷ 反復投与(遺伝性血管性浮腫1型又は2型患者)
国際共同第Ⅲ相試験において、HAE1型又は2型(C1-INH HAE)患者39例(日本人患者4例を含む)に本剤の初回用量400mgを皮下投与し、以降200mgを月1回皮下投与したときの本剤の血漿中トラフ濃度は以下の通りであった。定常状態における本剤の血漿中トラフ濃度は概ね一定であった。
■C1-INH HAE患者における本剤反復皮下投与時のガラダシマブの血漿中トラフ濃度
| Day 31 | Day 61 | Day 91 | Day 121 | Day 151 | Day 182 | |
|---|---|---|---|---|---|---|
| 例数 | 39 | 39 | 39 | 38 | 39 | 39 |
| 血漿中トラフ濃度(μg/mL)、 平均値(SD) | 10.5 (4.00) | 8.60 (3.91) | 8.39 (3.81) | 8.69 (3.93) | 8.20 (4.37) | 8.09 (4.28) |
❸ 母集団薬物動態解析
第Ⅰ相試験(外国人)及び第Ⅰ相試験(日本人を含む)、海外第Ⅱ相試験(2001試験)、並びに国際共同第Ⅲ相試験:VANGUARD試験(3001試験)及び国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)から、PKデータ及びFⅫaが介在するカリクレイン活性のデータを得て、母集団PK/PDモデルを構築した。なお、国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)には、海外第Ⅱ相試験(2001試験)及び国際共同第Ⅲ相試験:VANGUARD試験(3001試験)から移行した継続患者に加え、新規登録患者も含む。
母集団PK/PDモデル構築では逐次的なモデリングアプローチを適用し、まず母集団PKモデルを構築してから、個々のポストホックPK推定値(経験的ベイズ推定値)を得た。本解析については、段階的な仮説検定ではなく、パラメータ推定を重視する共変量モデリングアプローチを適用した。
【パラメータ要因】
(1) 体重の影響
体重は、母集団PK/PD最終モデルにおいてCL及びVCの変動を説明する重要な共変量であり、低体重の被験者で曝露が高かった。
ただし、PKには体重による差が認められたものの、曝露―反応(ER)解析では異なる体重間で月間HAE発作回数に差は認められなかった。
(2) 年齢の影響
試験併合データの母集団PK/PD及びER解析を用いて年齢の影響を検討した。
国際共同第Ⅲ相試験:VANGUARD試験(3001試験)及び国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)において、本剤のCtrough値及びFⅫaが介在するカリクレイン活性の阻害は、青少年患者と成人患者で同程度であった。
母集団PK解析において、最終モデルからの経験的ベイズ推定値を用いたシミュレーションにより年齢の影響を検討した。青少年被験者数は成人被験者数よりも少なかったが、青少年被験者と成人被験者とで曝露は同程度であった。モデルを用いて年齢の影響を検討した結果、青少年、成人及び高齢者における本剤のPKに臨床的に意義のある差は認められなかった。第Ⅱ相及び第Ⅲ相試験のHAE患者を対象とした母集団PK/PD解析において、年齢は、解析した年齢範囲(12~73歳)内で、本剤のPKに臨床的に意義のある影響を及ぼさないことが示された。
ERモデルの共変量に年齢を含めたが、モデルで予測されるHAE発作回数に顕著な変動は認められなかった。
(3) 性別の影響
併合PKデータセットには、男性HAE患者62例及び女性HAE患者111例が含まれた。
HAE患者のPKの比較では、本剤のPKに性差は認められなかった。
ERモデルの共変量に性別を含めたが、モデルで予測されるHAE発作回数に顕著な変動は認められなかった。
(4) 人種及び民族の影響
第Ⅰ相試験(日本人を含む)では、日本人被験者及び白人被験者に本剤200mgを皮下投与したときの本剤のPKは類似していた。
国際共同第Ⅲ相試験:VANGUARD試験(3001試験)では、本剤のCtrough及びFⅫaが介在するカリクレイン活性の阻害は、日本人患者と外国人患者で同程度であった。国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)において、本剤のCtrough及びFⅫaが介在するカリクレイン活性の阻害は、日本人患者、中国人患者及び非アジア人患者で同程度であった。
母集団PK/PD解析では、被験者の大半がアジア人以外の成人であり、アジア人被験者52例のうち、36例が日本人、10例が中国人であった。連続共変量の分布は、すべての人種及び民族集団で類似していた。試験データを併合した母集団PK/PD最終モデルに日本人(日本人vs外国人)及び中国人(中国人vs非中国人)の民族の効果を含めたが、本剤のCL及びAUCtau,ssに臨床的に意義のある影響は認められなかった。さらに、HAE患者のPKの比較では、本剤のPKに対して意義のある人種(アジア人vs非アジア人として分類)及び民族の影響は認められなかった。
ERモデルの共変量に民族を含めたが、モデルで予測されるHAE発作回数に顕著な変動は認められなかった。
(5) 特別な集団におけるPK
母集団PK/PD解析では、併合母集団PK/PD最終モデルに肝機能及び腎機能の間接指標(ベースラインの血清クレアチニン、ALT、ビリルビン)を含めたが、これらの共変量のいずれも本剤のCL又はAUCtau,ssに臨床的に意義のある影響を及ぼさなかった。
【PKパラメータ】
母集団PKモデルを用いて、本剤の初回用量400mgを皮下投与後、以降200mgを月1回皮下投与したHAE患者(海外第Ⅱ相試験(2001試験)、国際共同第Ⅲ相試験:VANGUARD試験(3001試験)及び国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)の患者)のPKパラメータを検討した。定常状態における1投与間隔の血漿中濃度-時間曲線下面積(AUCtau,ss)、定常状態における最高血漿中濃度(Cmax,ss)及び定常状態における最低血漿中濃度(Cmin,ss)の平均値(SD)は、それぞれ9,920(4,470)μg∙h/mL、20.5(9.66)μg/mL及び8.94(4.64)μg/mLと推定された。初回用量400mgの皮下投与後に本剤の曝露は定常状態に達した。
HAE患者における本剤皮下投与後の血漿中最高濃度到達時間は約6日であった。
HAE患者における本剤の見かけの分布容積の平均値(SD)は、8.36(5.55)Lであった。
HAE患者における本剤の見かけの全身クリアランスの平均値(SD)は0.0243(0.0122)L/hであり、終末相の消失半減期は約18日であった。
健康成人及びHAE患者を対象とした母集団薬物動態解析における絶対的アベイラビリティは、0.387(95%信頼区間:0.344, 0.431)と推定された。
【吸収】
吸収(健康成人:外国人データ)12)
健康成人において、注射部位(腹部、大腿部、上腕部)は本剤の曝露に影響しなかった。
1)Depetri F et al: Eur J Intern Med 2019; 59: 8-13
2)Maurer M et al: Allergy 2022; 77(7): 1961-1990
12)社内資料: 臨床薬理試験
13)社内資料: 非臨床試験の概要
14)Lera AL. Balkan Med J 2021; 38: 82-88
15)Kaplan AP. Blood 2022; 139: 2732-2733
16)Busse PJ and Christiansen SC. N Engl J Med 2020; 382: 1136-1148
17)Reshef A et al: J Allergy Clin Immunol 2024; 154(2): 398-411
18)社内資料: 薬理試験の概要