国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)
(日本人データを含む)
7)社内資料: 国際共同第Ⅲb相試験(CSL312_3002)(承認時評価資料)
利益相反: 本試験はCSLベーリングより資金援助を受けた。
試験概要
目的
C1-INH HAE患者の長期発作抑制におけるアナエブリ皮下投与の長期安全性及び有効性を評価する。
対象
HAE患者161例(C1-INH HAE患者159例及びFⅫ HAE患者2例)
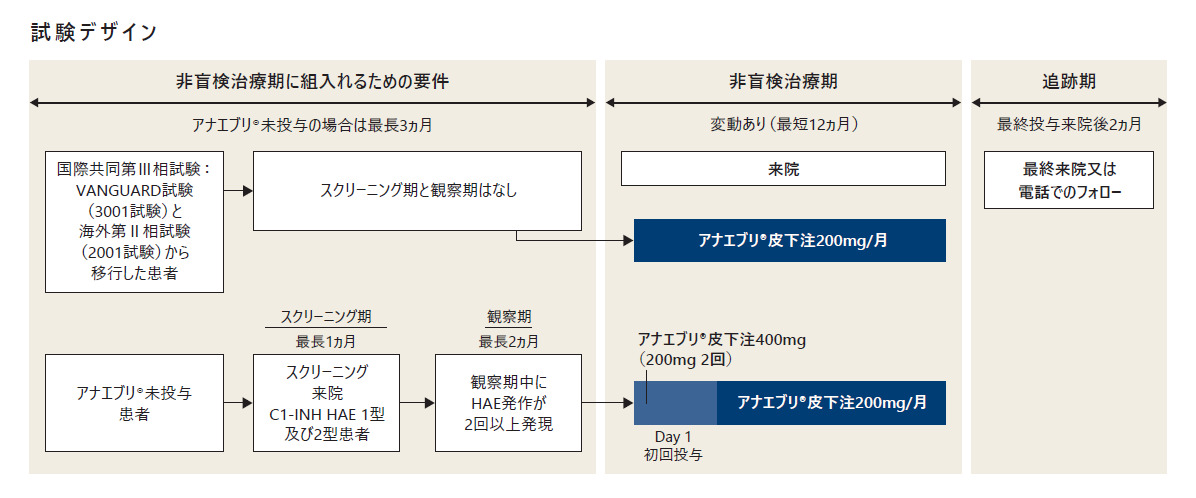
試験デザイン
多施設共同、非盲検、国際共同第Ⅲb相試験
なお本試験では以下の患者を適格とした。
・国際共同第Ⅲ相試験:VANGUARD試験(3001試験)に参加した患者
・海外第Ⅱ相試験(2001試験)に参加した患者
・アナエブリ投与歴のないC1-INH HAE 1型又は2型の新規登録患者(以下、「新規登録患者」)
方法
本試験はスクリーニング期(新規登録患者のみ)、観察期(新規登録患者のみ)、非盲検治療期及び追跡期の4期で構成された。
- スクリーニング期(新規登録患者のみ)
アナエブリ投与歴のない新規登録患者は、スクリーニング期(最長1ヵ月間)において本試験への組入れに対する適格性を判定した。 - 観察期(新規登録患者のみ)
スクリーニング後、適格患者は、観察期(1~2ヵ月間)に移行し、基礎疾患の状態の確認及び治療期参加に対する適格性の評価を受けた。患者は、観察期(最短1ヵ月間)を完了しなければならなかった。さらに、治療期への移行に適格となるためには、患者は観察期にHAE発作を2回以上発現する必要があった。観察期の最初の1ヵ月間(必須)にHAE発作が2回以上発現した患者は治療期へ移行することができた。
観察期の最初の1ヵ月間にHAE発作が発現しなかった患者は、最長2ヵ月間観察期に留まった。治療期への移行に適格となるには、その間にHAE発作が2回以上発現しなければならなかった。 - 治療期
適格性基準を満たした患者は、観察期後、治療期へ移行した。それぞれの治験実施計画書に従って国際共同第Ⅲ相試験:VANGUARD試験(3001試験)及び海外第Ⅱ相試験(2001試験)を完了した患者は、直接国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)の非盲検治療期へ移行することにより治療を継続する機会を得られた。
治療期では、アナエブリ(200mg)を月1回皮下投与した。アナエブリ投与歴のない新規登録患者には、Day 1来院時に初回用量として400mg(200mgを2回)、その後は月1回200mgを皮下投与した。いずれの患者もアナエブリを12ヵ月以上投与することとした。 - 追跡期
治療期終了来院の約2ヵ月後に患者に連絡を取り、最終の試験評価を完了した。
本試験では3回の中間解析を実施し、ここでは2回目の中間解析データ(データカットオフ日:2023年2月13日)を示した。
本試験は継続中である(2025年1月現在)。
■ 試験デザイン
評価項目
| 主要評価項目 | C1-INH HAE患者におけるTEAE |
|---|---|
| 副次評価項目 | ・月間(及び年間)HAE発作回数 ・観察期に対する治療期の月間HAE発作回数の減少率 ・要時治療(急性期治療)を要した月間(及び年間)HAE発作回数 ・中等度又は重度の月間(及び年間)HAE発作回数 ・SGART ・ TEAE、因果関係のあるTEAE、試験中止に至ったTEAE、重症度別のTEAE、特に注目すべき有害事象(血栓塞栓症、異常出血、アナフィラキシーを含む重度の過敏症)、重篤な有害事象、死亡 ・抗ガラダシマブ抗体 ・有害事象として報告された臨床検査所見 ・nC1-INH HAE患者におけるTEAE |
| 探索的評価項目 | ・アナエブリ投与歴のない新規登録患者におけるDay 1後及びDay 14後の初回発作までの期間 ・患者報告アウトカム(AE-QoL質問票、WPAI:GH質問票及びTSQM)及びIGART ・ 所定の時点でのガラダシマブ濃度及びFⅫaが介在するカリクレイン活性、ガラダシマブの薬物動態パラメータ(Cmax、Tmax、AUC0-30days) |
C1-INH HAE:Hereditary angioedema with C1-esterase inhibitor deficiency(C1-インアクチベーターの異常を伴う遺伝性血管性浮腫), TEAE: Treatment-emergent adverse event(試験治療下で発現した有害事象), HAE:Hereditary angioedema(遺伝性血管性浮腫), SGART: Subject’s Global Assessment of Response to Therapy(患者による治療反応性の全般評価) AE-QoL:Angioedema Quality of Life(Questionnaire)(腫れを繰り返す患者の生活の質(についての質問票)), WPAI:GH:Work Productivity and Activity Impairment:General Health(仕事の生産性及び活動障害に関する質問票:健康全般), TSQM:Treatment Satisfaction for Medication Questionnaire(投薬治療の満足度に関する質問票), IGART:Investigator’s Global Assessment of Response to Therapy(治験責任医師等による治療反応性の全般評価), PK:Pharmacokinetics(薬物動態), PD: Pharmacodynamic (薬力学), FXIIa: Activated coagulation Factor Ⅻ(活性化第Ⅻ因子), Cmax: Maximum concentration(最高血漿中濃度), Tmax : Time to Maximum Plasma Concentration(最高血漿中濃度到達時間), AUC: Area under the plasma concentration time curve(血漿中濃度-時間曲線下面積), nC1-INH-HAE:Hereditary angioedema with normal C1-esterase inhibitor(C1-インアクチベーターの正常な遺伝性血管性浮腫)
解析計画
| 有効性 | 月間(及び年間)HAE発作回数を、中央値(主要解析)及び平均値(副次解析)を対応する95%信頼区間とともに記述統計量で示した。レスポンダーの例数及び割合を対応する95%信頼区間とともに示した。観察期に対する治療期のHAE発作回数の減少率が50%以上である患者をレスポンダーに分類した。要時治療(急性期治療)を要した月間HAE発作回数について、特定の薬剤を服用した患者の例数及びその割合を要約した。中等度又は重度の月間HAE発作回数を要約した。SGARTの結果は来院別に要約した。 探索的評価項目については、QoL評価項目を要約し、一覧表として示した。ガラダシマブ血漿中濃度を要約し、表、図及び一覧表に示した。アナエブリ投与歴のない新規登録成人患者を対象とした部分集団解析では、初回用量の皮下投与後のガラダシマブの薬物動態特性を明らかにするため、追加のPK/PD用検体を採取し、ノンコンパートメント薬力学解析を用いてCmax、Tmax及びAUC0-30daysを算出した。FⅫaが介在するカリクレイン活性を個々の患者ごとに一覧表にし、測定時点、部分集団及び初回用量400mgの投与有無別に要約した。FⅫaが介在するカリクレイン活性(ベースラインに対する比率[%])を表、図及び一覧表に示した。 |
|---|---|
| 安全性 | C1-INH HAE患者におけるTEAEは、TEAEが発現した患者数及び割合、件数、並びに投与あたり及び人年法による発現率を要約した。TEAEの要約には、TEAE、重篤な有害事象、死亡、治験薬投与後24時間以内に発現したTEAE、因果関係のあるTEAE、試験中止に至ったTEAE、重症度別のTEAE、転帰別のTEAE、特に注目すべき有害事象(血栓塞栓症、異常出血、アナフィラキシーを含む重度の過敏症)を含めた。 TEAEの解析を、nC1-INH HAE患者に対しても同様に実施した。 |
患者背景(All Treated Subjects Analysis Set)
| アナエブリ200mg群(n=161) | ||
|---|---|---|
| 年齢、歳 | 平均値[SD] | 42.3[15.31] |
| 最小値,最大値 | 13, 73 | |
| 中央値 | 42.0 | |
| 性別、n(%) | 女性 | 101(62.7%) |
| 男性 | 60(37.3%) | |
| 人種、n(%) | アジア人 | 22(13.7%) |
| 日本人 | 12(7.5%) | |
| 黒人又はアフリカ系米国人 | 2(1.2%) | |
| ハワイ先住民/その他の太平洋諸島系住民 | 0 | |
| 白人 | 135(83.9%) | |
| その他 | 1(0.6%) | |
| 混血 | 1(0.6%) | |
| BMI( kg/m2) | 平均値[SD] | 28.1[6.21] |
| HAE type、n(%) | C1-INH HAE typeⅠ | 145(90.1%) |
| C1-INH HAE typeⅡ | 14(8.7%) | |
| FⅫ HAE | 2(1.2%) | |
2回目の中間解析のデータカットオフ時点で、161例中119例(73.9%)がアナエブリを12ヵ月以上投与され、曝露期間の中央値は13.83ヵ月(範囲:3.0~21.1ヵ月)であった。
安全性
■主要評価項目
C1-INH HAE患者
C1-INH HAE患者は159例組入れられ、2回目の中間解析のデータカットオフ時点で、有害事象はアナエブリ群で159例中133例(83.6%)
に発現し、副作用は159例中21例(13.2%)に発現した。
重篤な有害事象はアナエブリ群で3例(COVID-19 2例、遺伝性血管浮腫1例)に認められた。
試験中止に至った有害事象は2例(注射部位刺激感、気分動揺各1例)に認められた。死亡例は認められなかった。
有害事象の概要(Safety Analysis Set)
| アナエブリ群(n=159) | |
|---|---|
| 有害事象 | 133(83.6%) |
| 副作用 | 21(13.2%) |
| 重篤な有害事象 | 3 (1.9%) |
| 試験中止に至った有害事象 | 2 (1.3%) |
| 死亡 | 0 |
発現率3%以上の主な有害事象(Safety Analysis Set)
| アナエブリ群(n=159) | |
|---|---|
| 有害事象 | 133(83.6%) |
| 感染症および寄生虫症 | 95(59.7%) |
| COVID-19 | 57(35.8%) |
| 上咽頭炎 | 27(17.0%) |
| インフルエンザ | 11 (6.9%) |
| 上気道感染 | 9 (5.7%) |
| 副鼻腔炎 | 5 (3.1%) |
| 一般・全身障害および投与部位の状態 | 35(22.0%) |
| 注射部位紅斑 | 11 (6.9%) |
| 胃腸障害 | 30(18.9%) |
| 歯痛 | 6 (3.8%) |
| 下痢 | 5 (3.1%) |
| 筋骨格系および結合組織障害 | 27(17.0%) |
| 背部痛 | 6 (3.8%) |
| 呼吸器、胸郭および縦隔障害 | 21(13.2%) |
| 咳嗽 | 5 (3.1%) |
| 神経系障害 | 15 (9.4%) |
| 頭痛 | 10 (6.3%) |
■副次評価項目
❶ nC1-INH HAE患者
nC1-INH HAE患者は2例組入れられ、2回目の中間解析のデータカットオフ時点で、有害事象はアナエブリ群で2例中2例(100%)に発現し、その内訳はCOVID-19、失神が各1例であった。
副作用、重篤な有害事象、試験中止に至った有害事象、死亡例は認められなかった。
❷ すべてのHAE患者
2回目の中間解析のデータカットオフ時点で、有害事象はアナエブリ群で161例中135例(83.9%)に発現し、副作用は161例中21例
(13.0%)に発現した。
主な有害事象(発現率5%以上)は、アナエブリ群でCOVID-19が58例(36.0%)、上咽頭炎が27例(16.8%)、インフルエンザ、注射部位紅斑が各11例(6.8%)であった。
重篤な有害事象はアナエブリ群で3例(COVID-19 2例、遺伝性血管浮腫1例)に認められた。
試験中止に至った有害事象は2例(注射部位刺激感、気分動揺各1例)に認められた。死亡例は認められなかった。
有害事象の概要(Safety Analysis Set)
| アナエブリ群(n=161) | |
|---|---|
| 有害事象 | 135(83.9%) |
| 副作用 | 21(13.0%) |
| 重篤な有害事象 | 3 (1.9%) |
| 試験中止に至った有害事象 | 2 (1.2%) |
| 死亡 | 0 |
副作用(Safety Analysis Set)
| アナエブリ群(n=161) | |
|---|---|
| 副作用 | 21(13.0%) |
| 一般・全身障害および投与部位の状態 | 15 (9.3%) |
| 注射部位紅斑 | 11 (6.8%) |
| 注射部位そう痒感 | 4 (2.5%) |
| 注射部位蕁麻疹 | 2 (1.2%) |
| 疲労 | 1 (0.6%) |
| 注射部位刺激感 | 1 (0.6%) |
| 胃腸障害 | 2 (1.2%) |
| 腹部膨満 | 1 (0.6%) |
| 腹痛 | 1 (0.6%) |
| 皮膚および皮下組織障害 | 3 (1.9%) |
| 皮膚炎 | 1 (0.6%) |
| 紅斑 | 1 (0.6%) |
| 斑状丘疹状皮疹 | 1 (0.6%) |
| 神経系障害 | 2 (1.2%) |
| 頭痛 | 2 (1.2%) |
| 精神障害 | 2 (1.2%) |
| 不眠症 | 1 (0.6%) |
| 気分動揺 | 1 (0.6%) |
有効性
■副次評価項目
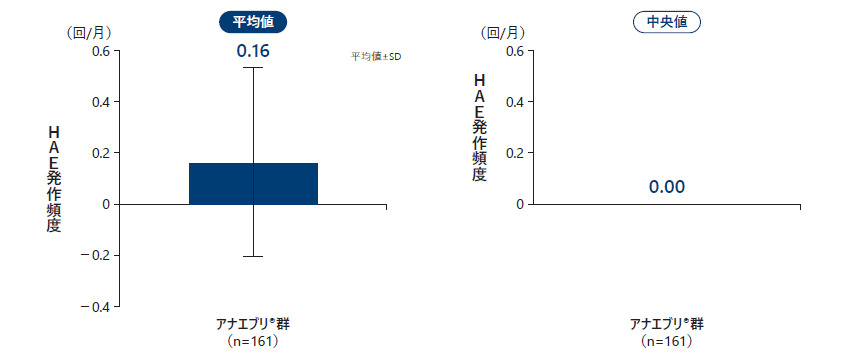
❶ 月間HAE発作回数
2回目の中間解析のデータカットオフ時点で、アナエブリ投与における治療期の月間HAE発作回数の平均値は0.16回/月、中央値は0.00回/月であった。
月間HAE発作回数(All Treated Subjects Analysis Set)副次評価項目
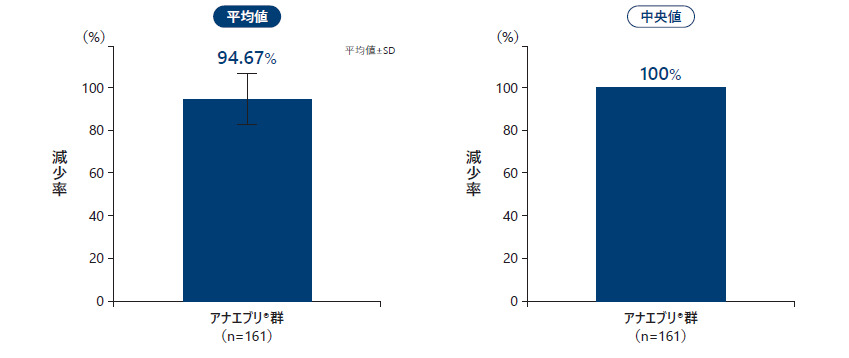
❷ 月間HAE発作回数の減少率
2回目の中間解析のデータカットオフ時点で、アナエブリ投与における観察期に対する治療期の月間HAE発作回数の減少率の平均値は94.67%、中央値は100%であった。
月間HAE発作回数の減少率(All Treated Subjects Analysis Set)副次評価項目
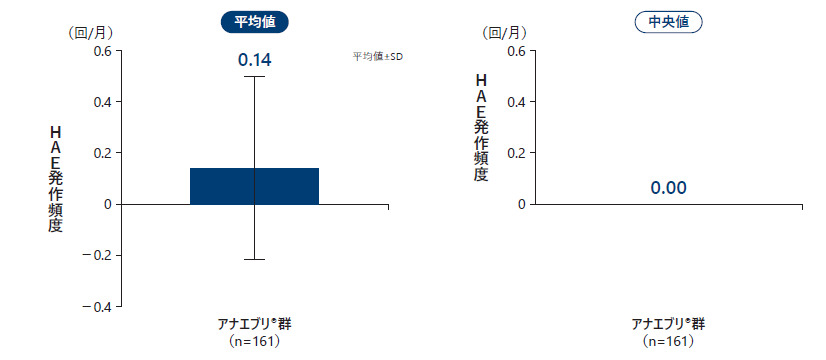
❸ 要時治療(急性期治療)を要した月間HAE発作回数
2回目の中間解析のデータカットオフ時点で、アナエブリ投与における、要時治療(急性期治療)を要した月間HAE発作回数の平均値は0.14回/月、中央値は0.00回/月であった。
要時治療(急性期治療)を要した月間HAE発作回数(All Treated Subjects Analysis Set)副次評価項目
❹ 中等度又は重度の月間HAE発作回数
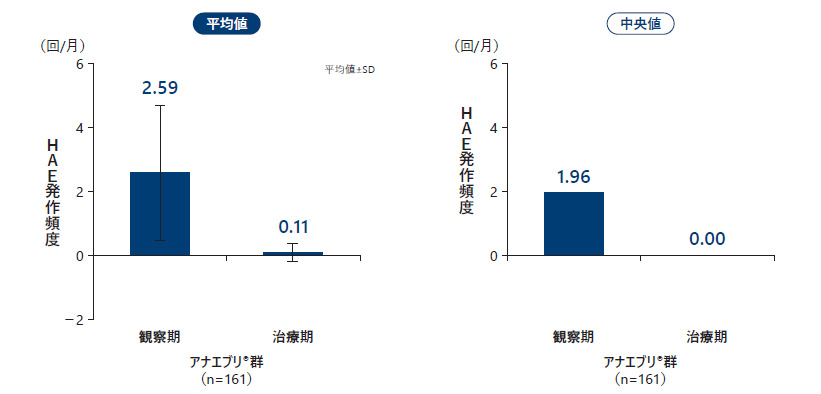
2回目の中間解析のデータカットオフ時点で、中等度又は重度の月間HAE発作回数の平均値は観察期2.59回/月、治療期0.11回/月であり、中央値は観察期1.96回/月、治療期0.00回/月であった。
中等度又は重度の月間HAE発作回数(All Treated Subjects Analysis Set)副次評価項目
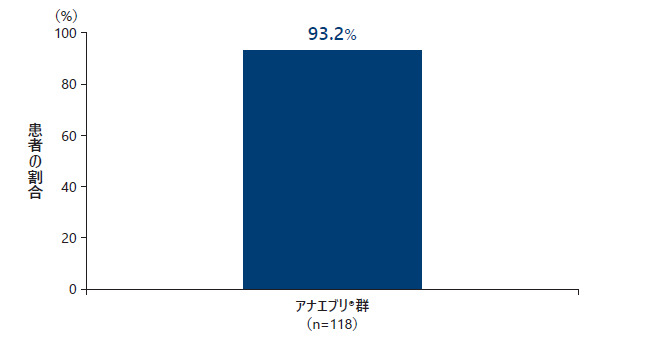
❹ SGARTで「中等度の改善」又は「著明な改善」と評価した患者の割合
2回目の中間解析のデータカットオフ時点で、12ヵ月時にSGARTで「中等度の改善」又は「著明な改善」と評価した患者の割合は118例中110例(93.2%)であった。
SGARTで「中等度の改善」又は「著明な改善」と評価した患者の割合(All Treated Subjects Analysis Set)副次評価項目
■探索的評価項目
❶ IGARTで「中等度の改善」又は「著明な改善」と評価された患者の割合
2回目の中間解析のデータカットオフ時点で、12ヵ月時に治験責任医師によりIGARTで「中等度の改善」又は「著明な改善」と評価された患者の割合は119例中117例(98.3%)であった。
IGARTで「中等度の改善」又は「著明な改善」と評価された患者の割合(All Treated Subjects Analysis Set)探索的評価項目
