国際共同第Ⅲ相試験:VANGUARD試験(3001試験)(日本人データを含む)
5) 社内資料: 国際共同第Ⅲ相試験(CSL312_3001)(承認時評価資料)
6) Craig TJ et al: Lancet 2023; 401(10382): 1079-1090
利益相反: 本試験はCSLベーリングより資金援助を受けた。著者にCSLベーリングよりコンサルタント料、謝礼、研究費を受領している者が含まれる。
試験概要
目的
HAE患者におけるHAE長期発作抑制としてのアナエブリ皮下投与の有効性及び安全性を評価する。
対象
C1-INH HAE患者64例
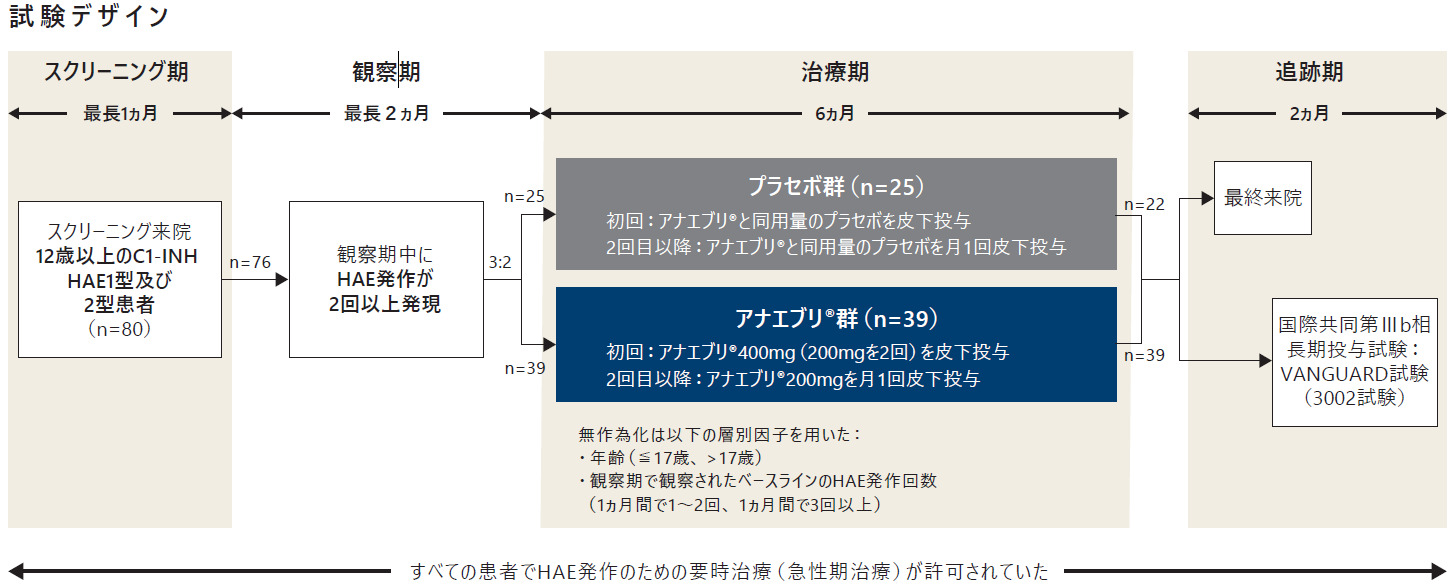
試験デザイン
多施設共同、二重盲検、無作為化、プラセボ対照、並行群間比較、国際共同第Ⅲ相試験
方法
スクリーニング期(最長1ヵ月間)、観察期(最長2ヵ月間)、治療期(6ヵ月間)及び2ヵ月間の追跡期(治験薬の最終投与
後3ヵ月間)又は国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)への移行の4パートで構成された。
- スクリーニング期(最長1ヵ月)
最長1ヵ月間のスクリーニング期において本試験への組入れに対する患者の適格性を判定した。スクリーニングを受け、すべての選択基準を満たし、除外基準に抵触しなかった患者が観察期へ移行した。観察期へ移行するための基準を30日以内に満たさなかった患者は、治験依頼者に確認の上、再スクリーニングを可能とした。再スクリーニングは1回のみ許容された。 - 観察期(最長2ヵ月)
観察期の最初の1ヵ月間(必須)にHAE発作が2回以上発現した患者が治療期へ移行することができた。観察期の最初の1ヵ月間にHAE発作が発現しなかった患者は、さらに最長1ヵ月間観察期に留まることができた。治療期への移行及び無作為化に適格となるには、最長2ヵ月間の観察期中にHAE発作が2回以上発現することを必須とした。 - 治療期(6ヵ月間)
適格患者を、アナエブリ群又はプラセボ群に3:2の比で無作為に割り付けた。
アナエブリ群
初回用量として、アナエブリ400mg(200mgを2回)を皮下投与した。2回目以降の投与は、予定日にアナエブリ200mgを月1回皮下投与した。
プラセボ群
初回投与は、アナエブリと同用量のプラセボを皮下投与した。2回目以降は、アナエブリと同用量のプラセボを予定日に月1回皮下投与した。 - 2ヵ月間の追跡期(治験薬の最終投与後3ヵ月間)又は国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)への移行
本試験を完了した患者は、国際共同第Ⅲb相長期投与試験:VANGUARD試験(3002試験)へ移行することができ、参加しない患者は追跡期来院(Day 242、治験薬の最終投与から約3ヵ月後)を完了することとした。
試験デザイン
評価項目
| 主要評価項目 | 6ヵ月間の月間(及び年間)HAE発作回数(検証的解析項目) |
|---|---|
| 副次評価項目 | ・ 6ヵ月間の治療期のプラセボ群に対するアナエブリ®群の月間HAE発作回数の平均値における相対減少率(検証的解析項目)、並びに治療期の前半3ヵ月間及び後半3ヵ月間の相対減少率 ・ 6ヵ月間の観察期に対する月間HAE発作回数の減少率及びレスポンダー(50%以上、70%以上、90%以上又は100%[無発作])、並びに前半3ヵ月間及び後半3ヵ月間の月間HAE発作回数の減少率及びレスポンダー(前半3ヵ月間の無発作は検証的解析項目) ・ SGARTで「著明な改善」、「中等度の改善」、「軽度の改善」、「ほぼ改善なし」又は「改善なし」と評価した患者の割合に基づく、治療期終了時点の治療反応性の分布の比較(検証的解析項目) ・ 6ヵ月間の要時治療(急性期治療)を要した月間(及び年間)HAE発作回数、並びに前半3ヵ月間及び後半3ヵ月間の要時治療(急性期治療)を要した月間(及び年間)HAE発作回数 ・ 6ヵ月間の中等度又は重度の月間(及び年間)HAE発作回数、並びに前半3ヵ月間及び後半3ヵ月間の中等度又は重度の月間(及び年間)HAE発作回数 ・前半3ヵ月間及び後半3ヵ月間の月間(及び年間)HAE発作回数 ・ 有害事象、特に注目すべき有害事象、重篤な有害事象、抗ガラダシマブ抗体、有害事象として報告された臨床検査所見 |
| 探索的評価項目 | ・ Day 1後及びDay 14後の初回の発作までの期間 ・ 患者報告アウトカムの測定(AE-QoL、EQ-5D-5L、WPAI:GH) ・ IGART など |
HAE:Hereditary angioedema(遺伝性血管性浮腫), SGART :Subject‘s Global Assessment of Response to Therapy(患者による治療反応性の全般評価), AE-QoL:Angioedema Quality of Life(Questionnaire)(腫れを繰り返す患者の生活の質(についての質問票)), EQ-5D-5L:EuroQoL-Group 5-Dimension 5-Level, WPAI:GH:Work Productivity and Activity Impairment:General Health(仕事の生産性及び活動障害に関する質問票:健康全般), IGART:Investigatorʼs Global Assessment of Response to Therapy(治験責任医師等による治療反応性の全般評価)
解析計画
| 有効性 | 有効性評価項目はITT Analysis Setを用いて解析した。副次評価項目はITT Analysis Setを用いて要約した。探索的評価項目はITT Analysis SetもしくはSafety Analysis Setを用いて要約した。 有効性の主要評価項目におけるアナエブリ®群とプラセボ群の差を検定するため、両側Wilcoxon検定(α=5%)を用いてアナエブリ群とプラセボ群の6ヵ月間の月間HAE発作回数を比較した。また、アナエブリ群及びプラセボ群の6ヵ月間の治療期中の月間及び年間HAE発作回数の記述統計量(中央値、平均値及び対応する95%信頼区間)を投与群別に示した。 連続変数は、平均値とそれぞれの95%信頼区間、SD、範囲、第1四分位数、第2四分位数、第3四分位数、及び欠損値及び非欠損値の数を用いて記述した。カテゴリカルデータは度数及び割合を用いて要約した。 |
|---|---|
| 多重性 | 主要評価項目及び3つの副次評価項目(プラセボ群に対する月間HAE発作回数の平均値における相対減少率、前半3ヵ月間の月間HAE発作回数の減少率が100%[無発作]の患者の割合及びSGART)をそれぞれ両側有意水準5%で階層手順を用いて検定した。階層手順に基づく仮説検定のプロセスは次の通りである。 (1) 主要評価項目の帰無仮説に関する1つ目の検定(H01:6ヵ月間のアナエブリ群の月間HAE発作回数はプラセボ群と同等である)を実施し、H01を棄却できた場合(両側p値が0.05未満)にのみ、2つ目の検定(H02:6ヵ月間のアナエブリ群の月間HAE発作回数のプラセボ群に対する平均値における減少率は0である)を実施する。 (2) H02を棄却できた場合にのみ、3つ目の検定(H03:前半3ヵ月間のアナエブリ群の無発作患者数はプラセボ群と同等である)を実施する。 (3) H03を棄却できた場合にのみ、4つ目の検定(H04:治療期終了時(Day 182)にSGARTで「著明な改善」又は「中等度の改善」と評価した患者の割合はアナエブリ群とプラセボ群で同等である)を実施する。 |
| PK/PD | 血漿中ガラダシマブ濃度は、個々の患者ごとに一覧表にし、PK Analysis Setを用いて測定時点別に要約した。時間に対するガラダシマブの個々の血漿中濃度及びその平均値を線形スケール及び片対数スケールでプロットした。血漿中ガラダシマブ濃度は、記述統計量(平均値、SD、変動係数(%)、中央値、最小値、最大値、第1四分位数及び第3四分位数、並びに幾何平均及び90%信頼区間)を用いて要約した。 薬力学データはPD Analysis Setを用いて、FⅫaが介在するカリクレイン活性及びFⅫ濃度を評価した。記述統計量(平均値、SD、変動係数、中央値、最小値、最大値、第1四分位数及び第3四分位数、並びに幾何平均及び90%信頼区間)を用いて、測定時点及び投与群別に要約した。すべての薬力学の濃度データを患者別に一覧に示した。 血漿中濃度の平均(SD)/活性―時間プロファイルを、測定時点に対してプロットした。FⅫaが介在するカリクレイン活性(ベースラインに対する比率[%])を表、図及び一覧表に示した。 |
| 安全性 | 安全性データはSafety Analysis Setを用いて要約した。発現日時が治験薬の初回投与後である有害事象をTEAEとみなした。発現日が欠測、若しくは発現日又は発現時刻の報告が不完全な有害事象も、その部分的な報告により当該有害事象が治験薬の初回投与前に発現したことが明らかでない限り、worst-case principleに従いTEAEとみなした。すべての有害事象を一覧表に示したが、解析にはTEAEのみを含めた。発現例数及び割合、TEAEの発現件数並びに1回投与あたり及び1人年あたり(該当する場合)のTEAEの発現件数を要約した。 |
ITT:Intention-to-treat, HAE: Hereditary angioedema(遺伝性血管性浮腫), SD: Standard deviation(標準偏差)
患者背景(ITT Analysis Set)
| プラセボ群*(n=25) | アナエブリ®群(n=39) | 全体(n=64) | ||
|---|---|---|---|---|
| 年齢、歳 | 平均値[SD] | 37.8[12.80] | 43.3[17.45] | 41.2[15.92] |
| 最小値,最大値 | 14, 62 | 12, 69 | 12, 69 | |
| 中央値 | 38.0 | 43.0 | 41.0 | |
| 性別、n(%) | 女性 | 14(56.0%) | 24(61.5%) | 38(59.4%) |
| 男性 | 11(44.0%) | 15(38.5%) | 26(40.6%) | |
| 人種、n(%) | アジア人 | 2(8.0%) | 4(10.3%) | 6(9.4%) |
| 日本人 | 2(8.0%) | 4(10.3%) | 6(9.4%) | |
| 黒人又はアフリカ系米国人 | 1(4.0%) | 0 | 1(1.6%) | |
| ハワイ先住民/ その他の太平洋諸島系住民 | 0 | 1(2.6%) | 1(1.6%) | |
| 白人 | 22(88.0%) | 33(84.6%) | 55(85.9%) | |
| その他 | 0 | 1(2.6%) | 1(1.6%) | |
| BMI (kg/m2) | 平均値[SD] | 28.4[7.56] | 27.9[6.02] | 28.1[6.61] |
| HAE type、n(%) | C1-INH HAE typeⅠ | 22(88.0%) | 34(87.2%) | 56(87.5%) |
| C1-INH HAE typeⅡ | 3(12.0%) | 5(12.8%) | 8(12.5%) | |
| 観察期のHAE発作回数、回 | 平均値[95%信頼区間] | 2.5[2.1-2.9] | 3.1[2.4-3.7] | ー |
ITT:Intention-to-treat BMI:Body mass index(体格指数), C1-INH HAE:Hereditary angioedema with C1-esterase inhibitor deficiency(C1-インアクチベーターの異常を伴う遺伝性血管性浮腫) , SD:Standard deviation(標準偏差)
有効性
■主要評価項目
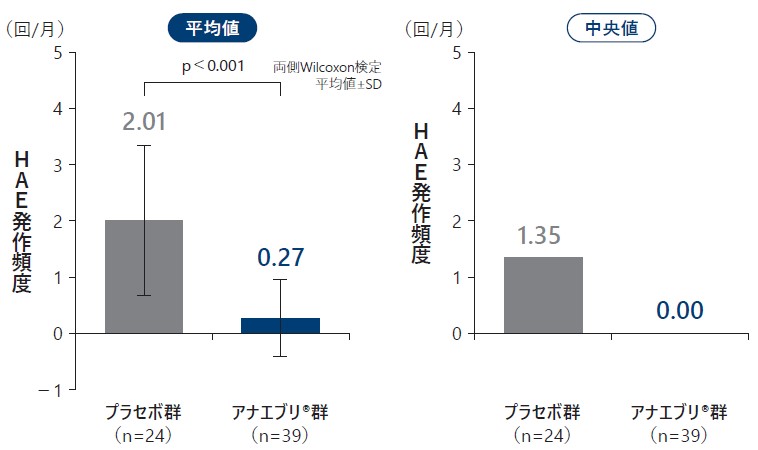
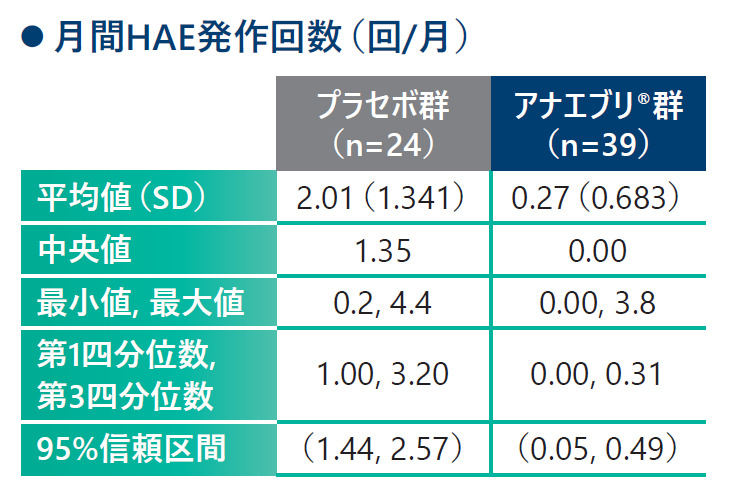
❶ 6ヵ月間の治療期における月間HAE発作回数(検証的解析結果 H01)
6ヵ月間の治療期における月間のHAE発作回数の平均値はプラセボ群で2.01回/月、アナエブリ®群で0.27回/月であり、アナエブリ®群で有意に低かった(検証的解析結果、p<0.001、両側Wilcoxon検定)。中央値はプラセボ群で1.35回/月、アナエブリ群で0.00回/月であった。
6ヵ月間の治療期における月間HAE発作回数[検証的解析結果](ITT Analysis Set)主要評価項目
■副次評価項目
❶ 6ヵ月間の治療期のプラセボ群に対する月間HAE発作回数の相対減少率(検証的解析結果 H02)
6ヵ月間の治療期のプラセボ群に対するアナエブリ群の月間HAE発作回数の平均値における相対減少率は、平均値で86.51%であり、有意に減少した(検証的解析結果、p<0.001、両側Wilcoxon検定)。また、月間HAE発作回数の中央値では100%減少した。
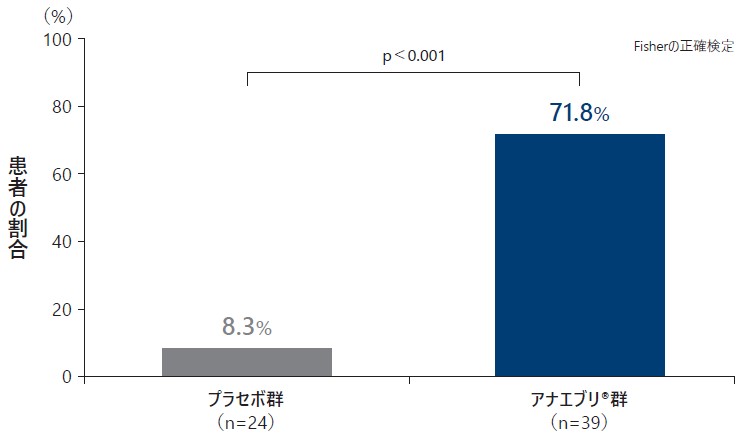
❷ 治療期前半3ヵ月間のHAE無発作の患者の割合(検証的解析結果 H03)
治療期前半3ヵ月間のHAE無発作の患者の割合は、プラセボ群で8.3%、アナエブリ群で71.8%であり、アナエブリ®群で有意に高かった(検証的解析結果、p<0.001、Fisherの正確検定)
治療期前半3ヵ月間のHAE無発作の患者の割合[検証的解析結果](ITT Analysis Set)副次評価項目
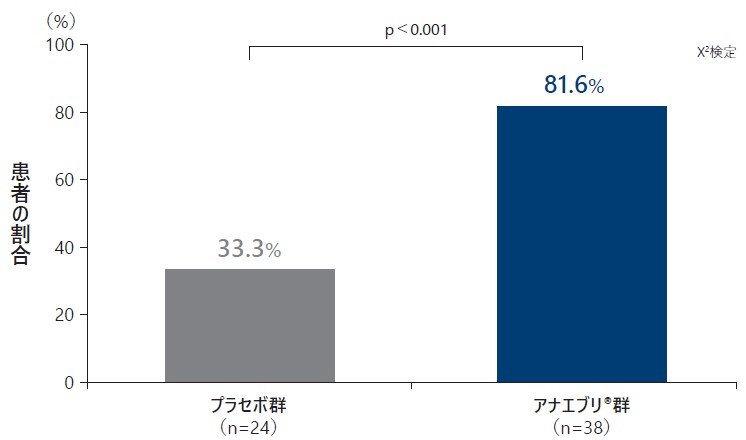
❸ SGARTで「中等度の改善」又は「著明な改善」と評価した患者の割合(検証的解析結果 H04)
SGARTで「中等度の改善」又は「著明な改善」と評価した患者の割合は、プラセボ群で33.3%、アナエブリ群で81.6%であり、アナエブリ群で有意に高かった(検証的解析結果、p<0.001、χ2検定)。
SGARTで「中等度の改善」又は「著明な改善」と評価した患者の割合[検証的解析結果](ITT Analysis Set)副次評価項目
❹ 6ヵ月間の治療期の月間HAE発作回数の観察期に対する減少率
6ヵ月間の治療期の月間HAE発作回数の観察期に対する減少率(平均値)はプラセボ群で20.21%、アナエブリ群で90.67%であった(名目上のp値:p<0.001、両側Wilcoxon検定)。前半3ヵ月間の月間HAE発作回数の減少率(平均値)は、プラセボ群で18.89%、アナエブリ群で91.10%であり、後半3ヵ月間ではプラセボ群で29.87%、アナエブリ群で90.12%であった。
6ヵ月間の治療期の月間HAE発作回数の観察期に対する減少率(平均値()ITT Analysis Set)副次評価項目

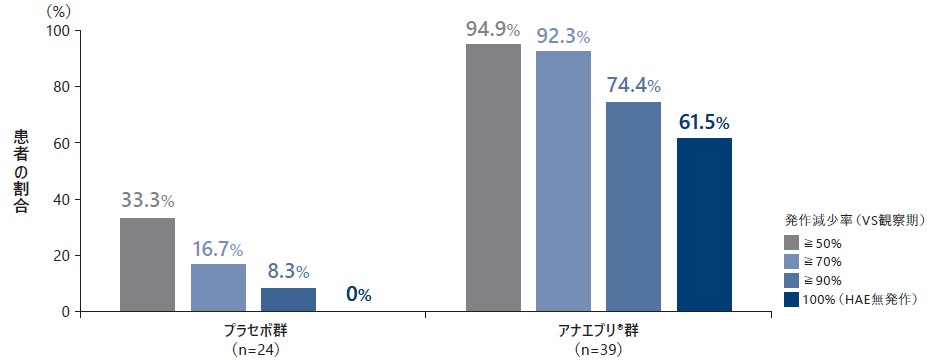
❺ 6ヵ月間の治療期のレスポンダー※の割合
6ヵ月間の治療期におけるレスポンダーの割合は、プラセボ群で33.3%、アナエブリ群で94.9%であった。観察期に対して月間HAE発作回数の減少率が70%以上の患者の割合は、プラセボ群で16.7%、アナエブリ群で92.3%、減少率90%以上の患者の割合は、プラセボ群で8.3%、アナエブリ群で74.4%であった。治療期中に無発作(減少率100%)の患者の割合は、プラセボ群で0%、アナエブリ群で61.5%であった。
月間HAE発作回数の減少率(観察期との比較)(ITT Analysis Set)副次評価項目
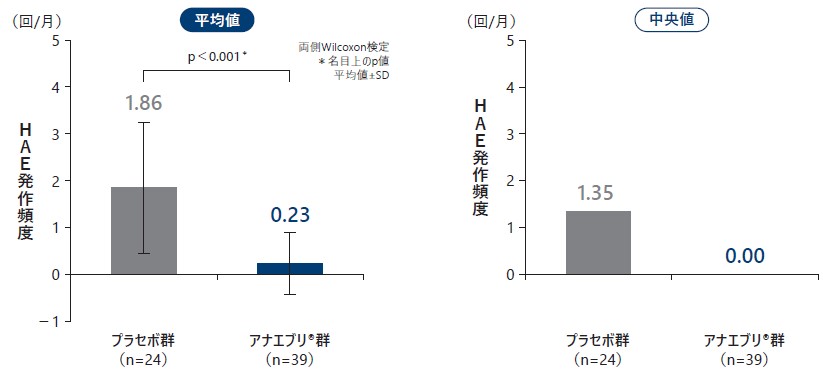
❻ 6ヵ月間の治療期の要時治療(急性期治療)を要した月間HAE発作回数
6ヵ月間の治療期における要時治療(急性期治療)を要した月間HAE発作回数の平均値は、プラセボ群で1.86回/月、アナエブリ群で0.23回/月であり(名目上のp値:p<0.001、両側Wilcoxon検定)、中央値はプラセボ群で1.35回/月、アナエブリ群で0.00回/月であった。
要時治療(急性期治療)を要した月間HAE発作回数(ITT Analysis Set)副次評価項目
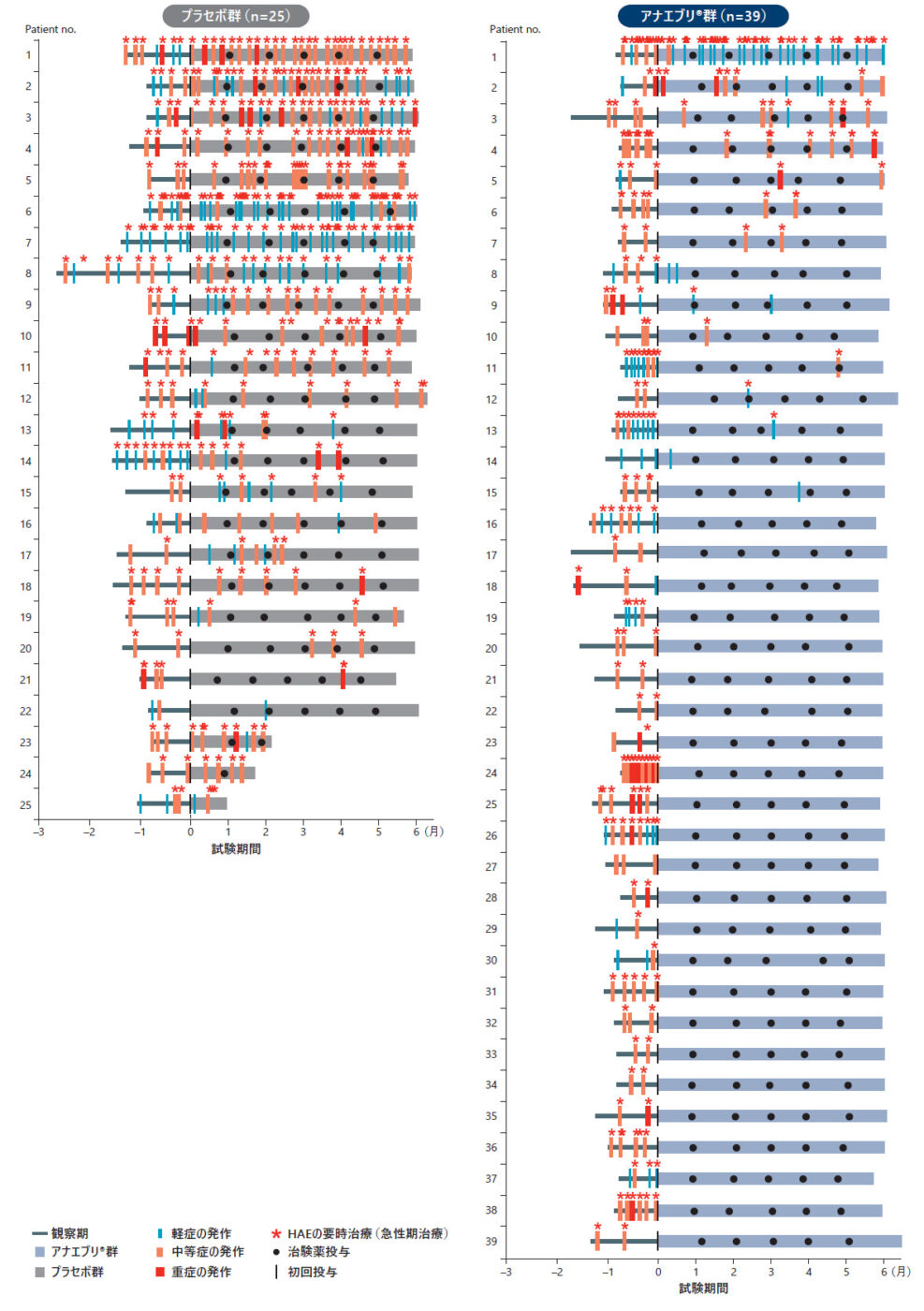
HAE発作の発症、重症度、導入期間及び治療期間中の要時治療(急性期治療)を要したHAE発作(ITT Analysis Set)副次評価項目
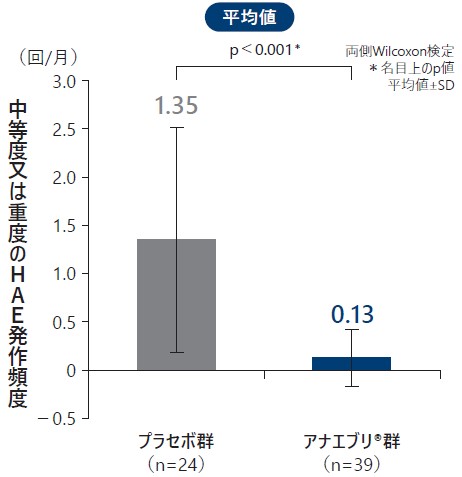
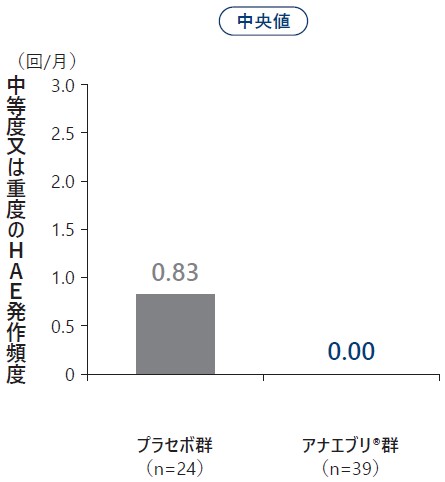
❼ 6ヵ月間の治療期の中等度又は重度のHAE発作回数
6ヵ月間の治療期における中等度又は重度のHAE発作回数の平均値はプラセボ群で1.35回/月、アナエブリ群で0.13回/月(名目上のp値:p<0.001、両側Wilcoxon検定)、中央値はプラセボ群で0.83回/月、アナエブリ群で0.00回/月であり、プラセボ群に対するアナエブリ群のHAE発作回数の平均値の減少率は90%であった。
中等度又は重度のHAE発作回数(ITT Analysis Set)副次評価項目
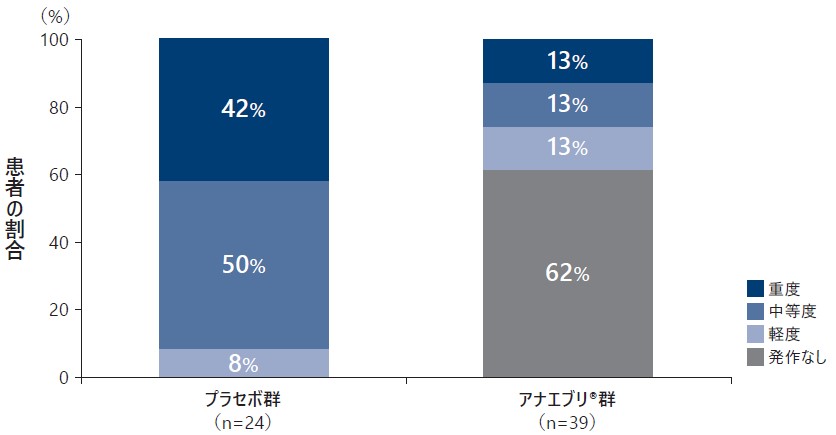
6ヵ月間の治療期における中等度又は重度のHAE発作を経験した患者の割合は、プラセボ群では重度42%、中等度50%であり、アナエブリ群では重度13%、中等度13%であった。
重症度別にみた6ヵ月間の治療期中にHAE発作を経験した患者の割合(ITT Analysis Set)副次評価項目
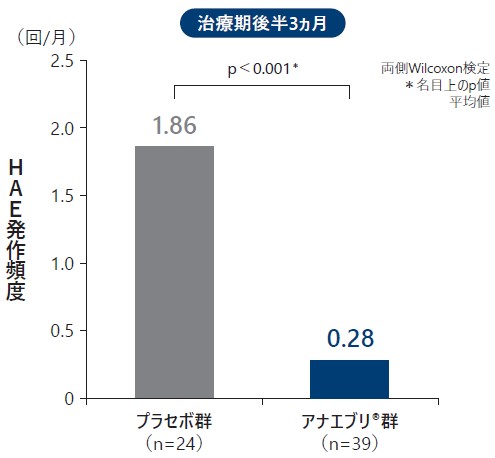
❽ 治療期前半3ヵ月と後半3ヵ月の月間HAE発作回数
治療期前半3ヵ月の月間HAE発作回数の平均値は、プラセボ群で1.97回/月、アナエブリ群で0.26回/月であり(名目上のp値:p<0.001、両側Wilcoxon検定)、治療期後半3ヵ月の月間HAE発作回数の平均値はプラセボ群で1.86回/月、アナエブリ群で0.28回/月であった(名目上のp値:p<0.001、両側Wilcoxon検定)。
治療期前半3ヵ月と後半3ヵ月の月間HAE発作回数(平均値)(ITT Analysis Set)副次評価項目

■探索的評価項目
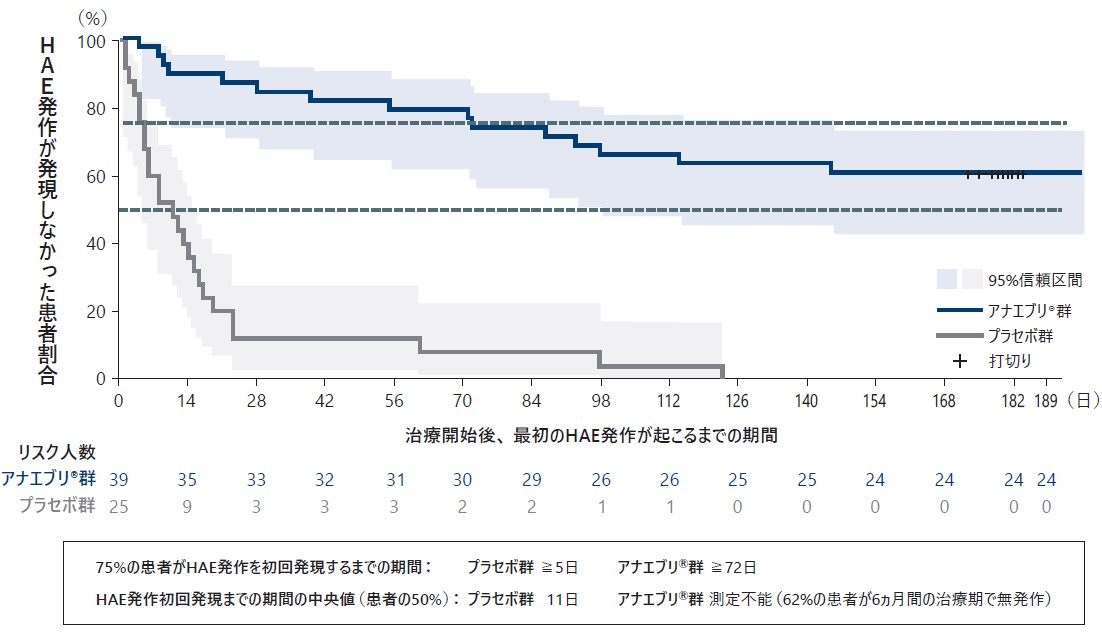
❶ Day 1後の初回発作までの期間
Day 1を起点としたHAE発作の初回発現までの期間については、プラセボ群では75%の患者で無発作期間が5日以上であったのに対し、アナエブリ群では75%以上の患者で無発作期間が72日以上であった。
治療開始後、最初のHAE発作が起こるまでの期間(Safety Analysis Set)探索的評価項目
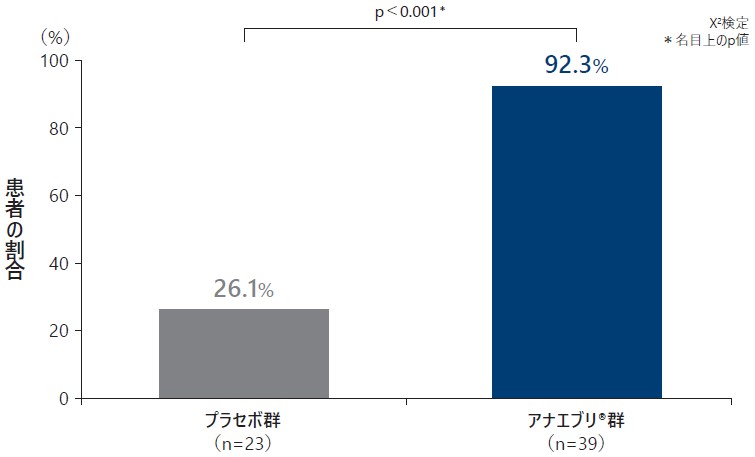
❷ IGARTで「中等度の改善」又は「著明な改善」であった患者の割合
治療終了時に、治験責任医師によりIGARTで「中等度の改善」又は「著明な改善」と評価された患者の割合はプラセボ群で26.1%、アナエブリ群で92.3%であった(名目上のp値:p<0.001、χ2検定)。
IGARTで「中等度の改善」又は「著明な改善」であった患者の割合(ITT Analysis Set)探索的評価項目
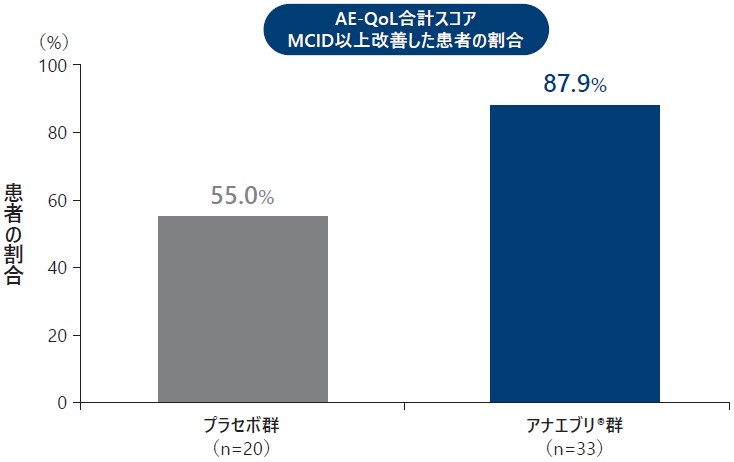
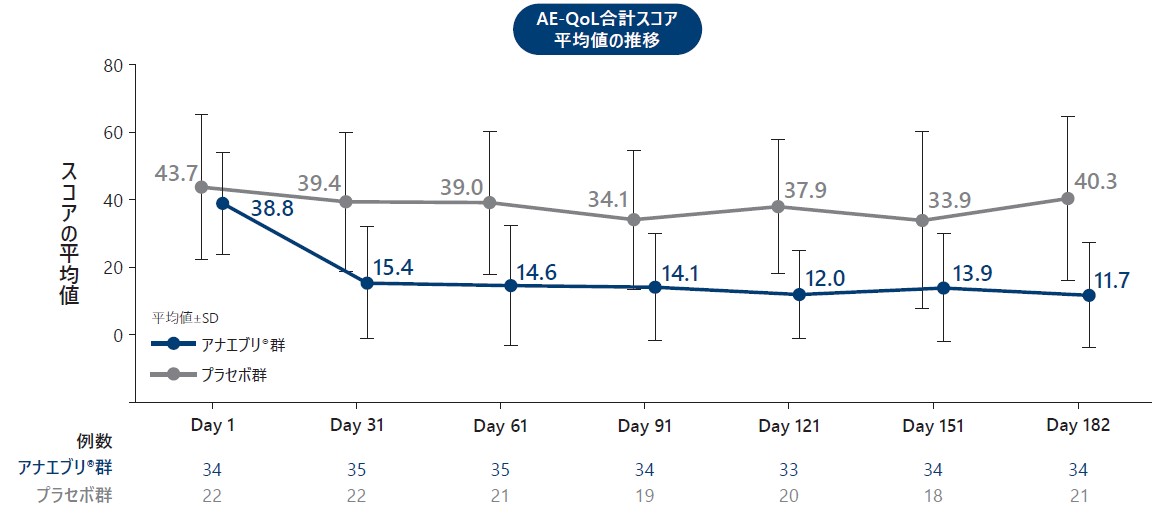
❸ 参考情報:患者報告アウトカム質問票(AE-QoL合計スコア、EQ-5D-5L及びWPAI:GH)
患者アウトカム質問票について、プラセボ群とアナエブリ群における6ヵ月間の治療期でAE-QoL合計スコアが臨床的に意義のある最小差(MCID:6ポイント)以上改善した患者の割合、AE-QoL合計スコアの平均値の推移、EQ-5D-5LのHSV及びVASスコアの平均値の推移、ドメイン別WPAI:GHスコアのベースラインからの変化量は以下の通りであった。
6ヵ月間の治療期でAE-QoL合計スコアが臨床的に意義のある最小差(MCID:6ポイント)以上改善した患者の割合及び
AE-QoL合計スコア(平均値)の推移(ITT Analysis Set)探索的評価項目
6ヵ月間の治療期におけるEQ-5D-5L各スコア(平均値)の推移(ITT Analysis Set)探索的評価項目
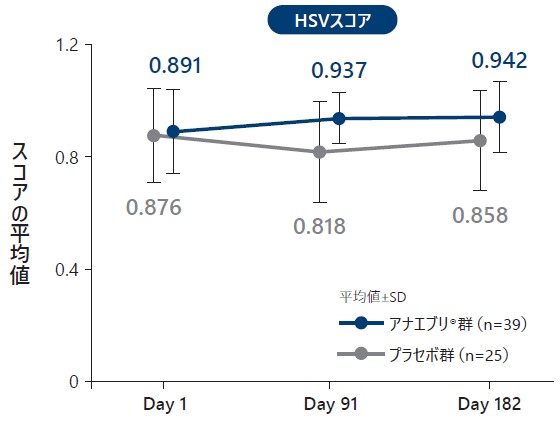
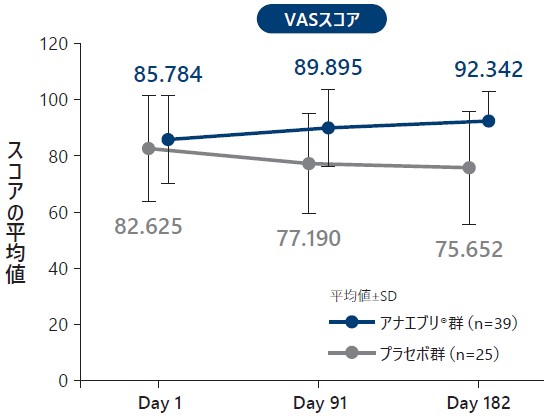
HSVスコア及びVASスコアは、スコアが高いほど健康状態が良好であることを示す
各ドメイン別のWPAI:GHスコア(平均値)の6ヵ月間の治療期におけるベースラインからの変化量(ITT Analysis Set)探索的評価項目
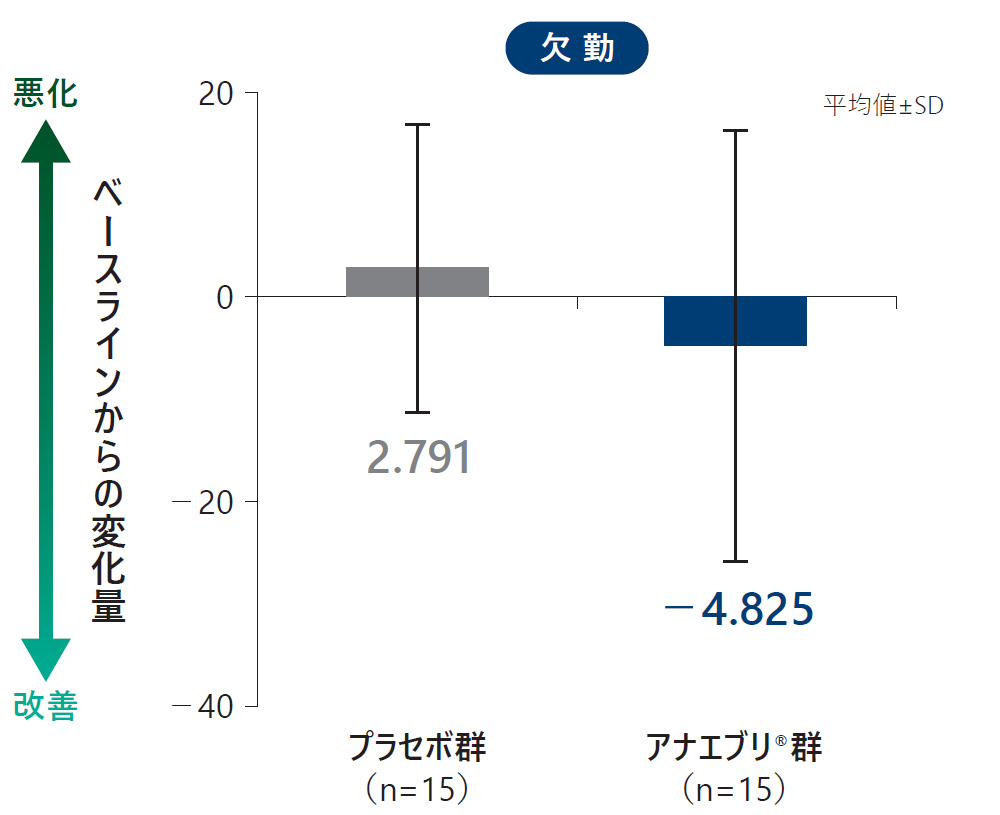
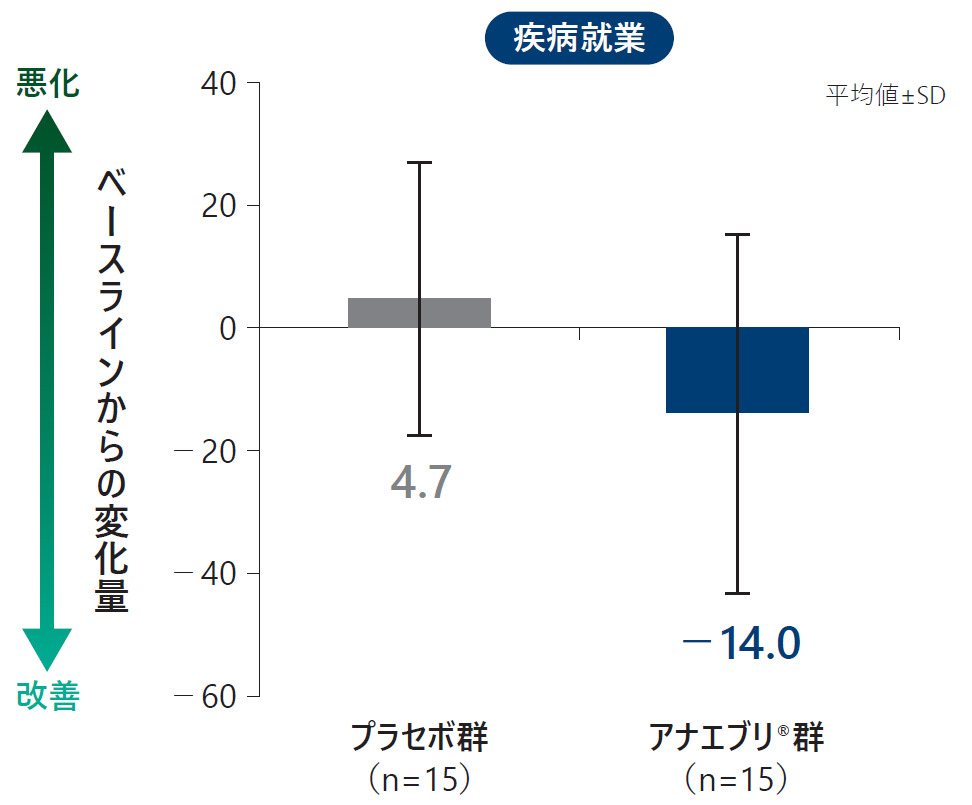
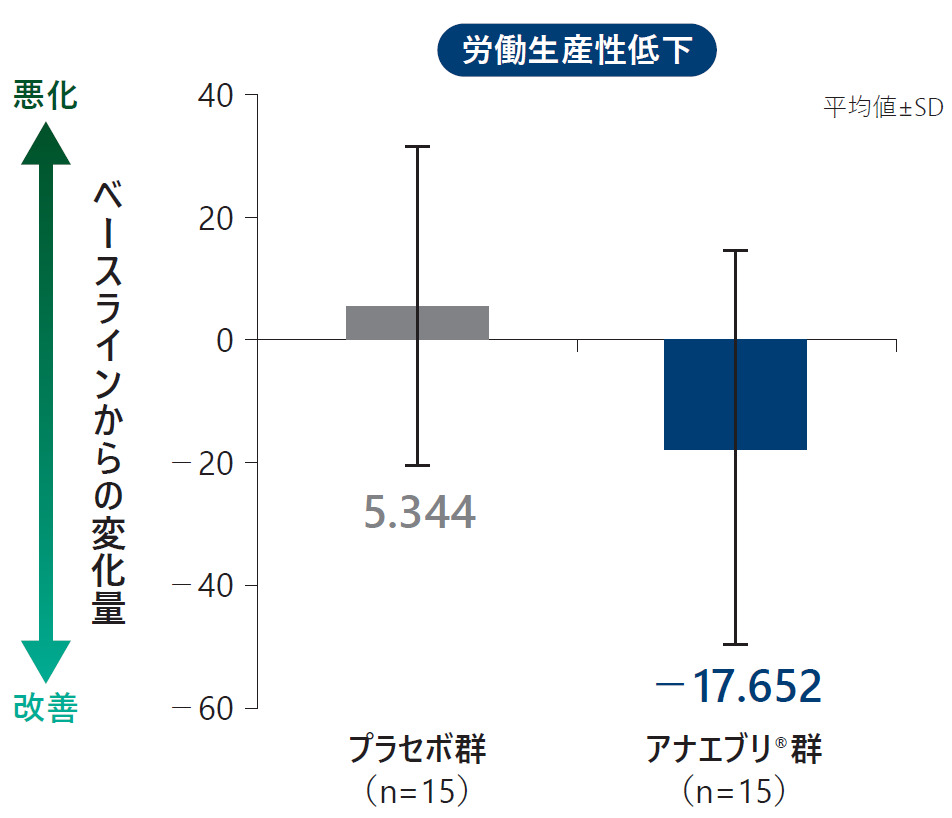
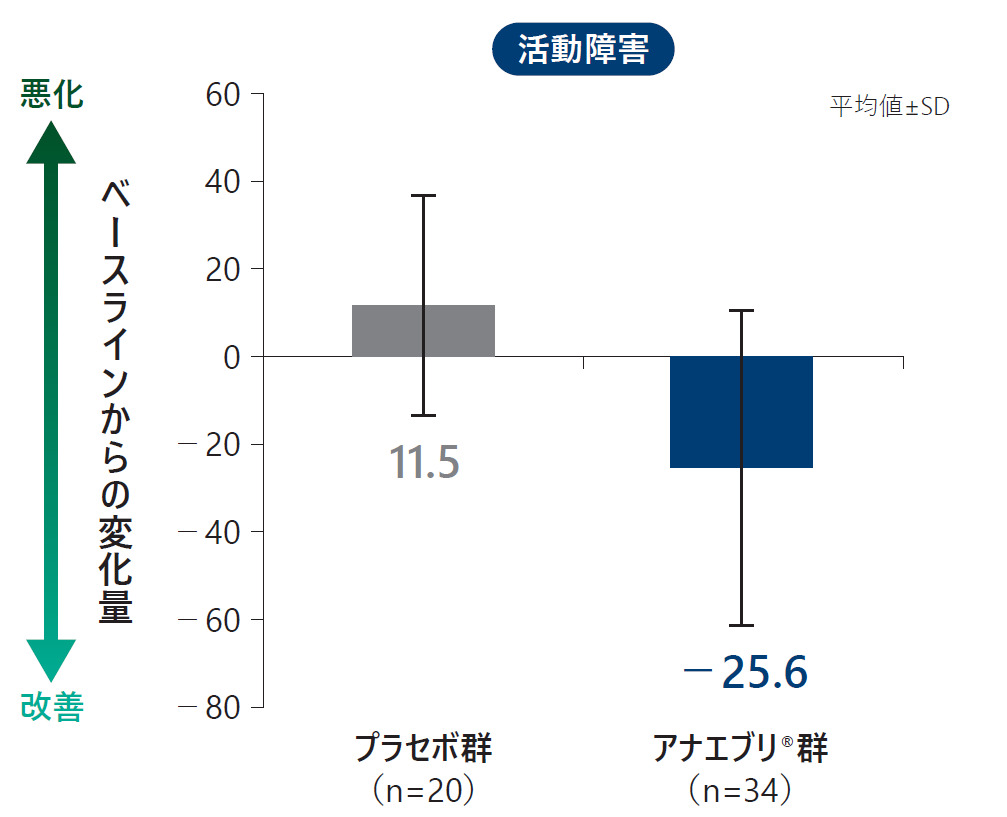
安全性
有害事象はアナエブリ群で39例中25例(64.1%)、プラセボ群で25例中15例(60.0%)に発現し、副作用はアナエブリ群で39例中4例(10.3%)、プラセボ群で25例中3例(12.0%)に発現した。
主な有害事象(発現率5%以上)はアナエブリ群で上気道感染が4例(10.3%)、上咽頭炎、頭痛が各3例(7.7%)、消化管感染、結膜炎、副鼻腔炎、尿路感染、下痢、腹痛、背部痛、口腔咽頭痛、視力障害が各2例(5.1%)であり、プラセボ群で頭痛が4例(16.0%)、COVID-19、疲労が各3例(12.0%)、上気道感染、悪心、注射部位紅斑、発熱、四肢痛が各2例(8.0%)であった。
重篤な有害事象はアナエブリ群で遺伝性血管浮腫が1例(報告用語:喉頭発作後の経過観察のための一泊入院)に認められ、プラセボ群では認められなかった。
試験中止に至った有害事象、死亡例は両群ともに認められなかった。
基準値上限を上回るaPTT延長がアナエブリ群の3例に認められた。プラセボ群では認められなかった。また、アナエブリ群の2例が抗ガラダシマブ抗体検査で陽性を示した。
有害事象の概要(Safety Analysis Set)
| アナエブリ®群(n=39) | プラセボ群(n=25) | |
|---|---|---|
| 有害事象 | 25(64.1%) | 15(60.0%) |
| 副作用 | 4(10.3%) | 3(12.0%) |
| 重篤な有害事象* | 1 (2.6%) | 0 |
| 試験中止に至った有害事象 | 0 | 0 |
| 死亡 | 0 | 0 |
*アナエブリ群の1例は、遺伝性血管浮腫(報告用語:喉頭発作後の経過観察のための一泊入院)であった。治験薬との因果関係は否定され、転帰は回復であった。
例数(%) MedDRA version 25.0
副作用(Safety Analysis Set)
| アナエブリ®群(n=39) | プラセボ群(n=25) | |
|---|---|---|
| 副作用 | 4(10.3%) | 3(12.0%) |
| 注射部位反応** | 2 (5.1%) | 2 (8.0%)*** |
| 注射部位紅斑 | 1 (2.6%) | 2 (8.0%) |
| 注射部位内出血 | 1 (2.6%) | 0 |
| 注射部位そう痒感 | 1 (2.6%) | 0 |
| 一般・全身障害および投与部位の状態 | 2 (5.1%) | 3(12.0%) |
| 注射部位紅斑 | 1 (2.6%) | 2 (8.0%) |
| 疲労 | 0 | 1 (4.0%) |
| 注射部位内出血 | 1 (2.6%) | 0 |
| 注射部位そう痒感 | 1 (2.6%) | 0 |
| 臨床検査 | 1 (2.6%) | 0 |
| プロトロンビンフラグメント1 ・2増加 | 1 (2.6%) | 0 |
| 神経系障害 | 1 (2.6%) | 0 |
| 頭痛 | 1 (2.6%) | 0 |
** 申請者が器官別大分類として別途設定した集計カテゴリーであるが、これらの事象はMedDRAで属する器官別大分類及び基本語においても集計した。
*** プラセボ群の患者2例のうち1例にワクチン接種部位反応が認められ、注射部位反応として報告された。
例数(%) MedDRA version 25.0